
【题目】某有机物![]() 分子中含有多种官能团,其结构简式为:
分子中含有多种官能团,其结构简式为: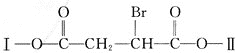
![]() 其中Ⅰ、Ⅱ为未知部分
其中Ⅰ、Ⅱ为未知部分![]() 。为推测X的分子结构,进行如图转化:
。为推测X的分子结构,进行如图转化:
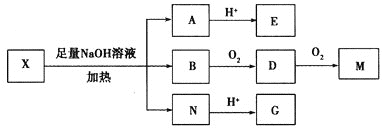
已知![]() 核磁共振氢谱显示有两组峰,峰面积之比为
核磁共振氢谱显示有两组峰,峰面积之比为![]() ;向G的水溶液中滴入
;向G的水溶液中滴入![]() 溶液发生显色反应;E、M都能与
溶液发生显色反应;E、M都能与![]() 溶液反应。请回答:
溶液反应。请回答:
![]() 的结构简式为________________________;D分子中所含官能团的结构简式是____________。B的系统命名法名称为________。
的结构简式为________________________;D分子中所含官能团的结构简式是____________。B的系统命名法名称为________。
![]() 可以发生的反应有
可以发生的反应有![]() 选填序号
选填序号![]() ________。
________。
①加成反应 ②消去反应 ③氧化反应 ④取代反应
![]() 两分子E在一定条件下可生成含有六元环的有机化合物,写出E发生此反应的化学方程式:_____________________________________。
两分子E在一定条件下可生成含有六元环的有机化合物,写出E发生此反应的化学方程式:_____________________________________。
![]() 若在X分子结构中,Ⅱ里含有能与氯化铁溶液发生显色反应的官能团,且G与溴水反应生成的一溴代物有2种,则X与足量NaOH溶液反应的化学方程式为:______________________________________。
若在X分子结构中,Ⅱ里含有能与氯化铁溶液发生显色反应的官能团,且G与溴水反应生成的一溴代物有2种,则X与足量NaOH溶液反应的化学方程式为:______________________________________。
![]() 是相对分子质量比E大14的链状有机化合物,组成元素和E相同,F分子中只含2种官能团,
是相对分子质量比E大14的链状有机化合物,组成元素和E相同,F分子中只含2种官能团,![]() 与足量金属钠反应能放出
与足量金属钠反应能放出![]() 氢气,核磁共振氢谱显示F有四组吸收峰,则符合条件的F的结构简式为
氢气,核磁共振氢谱显示F有四组吸收峰,则符合条件的F的结构简式为![]() 说明:同一个碳上不能连有多个羟基
说明:同一个碳上不能连有多个羟基![]() __________________。
__________________。
【答案】![]()
![]() 1,
1,![]() 丙二醇 ①③④ 2
丙二醇 ①③④ 2![]()
![]()

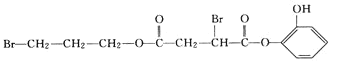 +6NaOH
+6NaOH![]() HOCH2CH2CH2OH+NaOOCCH2CH(OH)COONa+
HOCH2CH2CH2OH+NaOOCCH2CH(OH)COONa+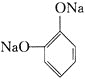
![]()
![]() 、
、![]() 、
、![]() 、
、![]()
【解析】
由X的结构简式![]() 知与NaOH反应时,生成Ⅰ
知与NaOH反应时,生成Ⅰ![]() 、
、![]() 、Ⅱ
、Ⅱ![]() 。再由M的信息推出M为
。再由M的信息推出M为![]() ,进一步回推D为
,进一步回推D为![]() 、B为
、B为![]() ,而且G中含有苯酚结构,所以N中含有
,而且G中含有苯酚结构,所以N中含有 结构,那么A为
结构,那么A为![]() ,E为
,E为![]() ,再结合X的分子式和第
,再结合X的分子式和第![]() 小题的信息推出G为
小题的信息推出G为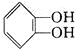 ,N为
,N为![]() ,进一步推出X为
,进一步推出X为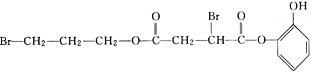 ,以此来解答。
,以此来解答。
由X的结构简式![]() 知与NaOH反应时,生成Ⅰ
知与NaOH反应时,生成Ⅰ![]() 、
、![]() 、Ⅱ
、Ⅱ![]() 。再由M的信息推出M为
。再由M的信息推出M为![]() ,进一步回推D为
,进一步回推D为![]() 、B为
、B为![]() ,而且G中含有苯酚结构,所以N中含有
,而且G中含有苯酚结构,所以N中含有 结构,那么A为
结构,那么A为![]() ,E为
,E为![]() ,再结合X的分子式和第
,再结合X的分子式和第![]() 小题的信息推出G为
小题的信息推出G为 ,N为
,N为![]() ,进一步推出X为
,进一步推出X为 ,
,
![]() 有上述分析可知,M为
有上述分析可知,M为![]() ,D为
,D为![]() ,所含官能团为
,所含官能团为![]() ,B为
,B为![]() ,名称为1,
,名称为1,![]() 丙二醇,
丙二醇,
故答案为:![]() ;
;![]() ;1,
;1,![]() 丙二醇;
丙二醇;
![]()
 ,含有苯环能发生加成反应,含有酚羟基能发生氧化反应和取代反应,故
,含有苯环能发生加成反应,含有酚羟基能发生氧化反应和取代反应,故![]() ,
,
故答案为:![]() ;
;
![]() 为
为![]() ,两分子E通过酯化反应生成六元环酯,方程式为:2
,两分子E通过酯化反应生成六元环酯,方程式为:2![]()
![]()
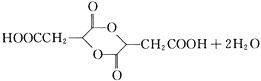 ,
,
故答案为:2![]()
![]()
 ;
;
![]() 为
为 ,与足量NaOH溶液反应的化学方程式为:
,与足量NaOH溶液反应的化学方程式为: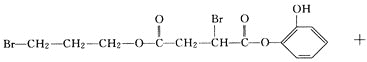
![]()
![]() ,
,
故答案为:
![]()

![]() ;
;
![]() 是相对分子质量比E大14的链状有机化合物,所以F分子式为
是相对分子质量比E大14的链状有机化合物,所以F分子式为![]() ,F分子中只含2种官能团,1molF与足量金属钠反应能放出1.5mol氢气,分子结构中含羟基和羧基共三个,含两个羧基一个羟基的同分异构体为:
,F分子中只含2种官能团,1molF与足量金属钠反应能放出1.5mol氢气,分子结构中含羟基和羧基共三个,含两个羧基一个羟基的同分异构体为:![]() 、
、![]() 、
、![]() ,含3个羟基的同分异构体为
,含3个羟基的同分异构体为![]() ;
;
故答案为:![]() 、
、![]() 、
、![]() 、
、![]() 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】冰晶胞中水分子的空间排列方式与金刚石晶胞(其晶胞结构如图,其中空心球所示原子位于立方体的顶点及面心,实心球所示原子位于立方体内)类似。有关冰晶胞的说法合理的是

A.冰晶胞内水分子间以共价键相结合
B.晶体冰与金刚石晶体硬度都很大
C.冰分子间的氢键具有方向性和饱和性,也是一种σ键
D.氢键的存在导致冰晶胞与金刚石晶胞微粒的排列方式类似
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在室温下,下列五种溶液:①0.1 mol/L NH4Cl溶液,②0.1 mol/L CH3COONH4溶液,③0.1 mol/L NH4HSO4溶液,④0.1 mol/L 氨水,⑤0.1 mol/L NH3·H2O和0.1 mol/L NH4Cl混合液(显碱性)。请根据要求填写下列空白:
(1)溶液①呈____________性(填“酸”、“碱”或“中”),其原因是___________(用离子方程式表示)
(2)在上述①、②、③、④溶液中c(NH4+)浓度由大到小的顺序是_________。(填序号)
(3)在溶液⑤中,各离子浓度大小顺序为___________。
(4)室温下,测得溶液②的pH=7,则 CH3COO—与NH4+浓度的大小关系是c(CH3COO—)________c(NH4+)(填“>”、“<”或“=”)。
(5)常温下,0.1 mol/ L CH3COOH溶液加水稀释过程中,下列表达式的数值变大的是____________(填字母)。
A. c(H+) B. c(H+)/ c(CH3COOH) C. c(H+)·c(OH-)
D. c(OH-)/ c(H+) E. c(H+)·c(CH3COO-) / c(CH3COOH)
(6)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
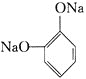
【题目】已知有机物F和高分子N的合成路线如图所示:
已知:RCH=CHR'![]() RCOOH+R'COOH,RCH=CHR'
RCOOH+R'COOH,RCH=CHR'![]() RCHO+R'CHO
RCHO+R'CHO
![]() 只含碳、氢、氧三种元素,且其碳、氢、氧元素质量比为
只含碳、氢、氧三种元素,且其碳、氢、氧元素质量比为![]() ,经测定Q的相对分子质量是128。
,经测定Q的相对分子质量是128。![]() 可与
可与![]() 加成,并能与
加成,并能与![]() 恰好完全反应,且分子中无支链。Q的分子式是 ______________。
恰好完全反应,且分子中无支链。Q的分子式是 ______________。
![]() 所含官能团的名称是 ___________、 _____________;
所含官能团的名称是 ___________、 _____________;![]() 的反应类型是 ________________;
的反应类型是 ________________;
![]() 写出C与银氨溶液反应的化学方程式: _______________;
写出C与银氨溶液反应的化学方程式: _______________;
![]() 的结构简式是 _______________;Q的反式结构简式是 ____________。
的结构简式是 _______________;Q的反式结构简式是 ____________。
![]() 下列说法正确的是 _________________。
下列说法正确的是 _________________。
A. C能与苯酚在一定条件下生成高分子化合物
B. D催化加氢的产物与F互为同分异构体
C. F能发生氧化反应、取代反应、加成反应
D. 高分子N的每条分子链中含有![]() 个酯基
个酯基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】莫尔法是一种沉淀滴定法,以K2CrO4为指示剂,用标准硝酸银溶液滴定待测液,进行测定溶液中Cl-的浓度。已知:
银盐 性质 | AgCl | AgBr | Ag2CrO4 |
颜色 | 白 | 浅黄 | 砖红 |
滴定终点的现象是______,终点现象对应的离子反应方程式为______。为了测定产品中(NH4)2Cr2O7的含量,称取样品0.1500g,置于锥形瓶中,加50mL水,再加入2g KI(过量)及稍过量的稀硫酸溶液,摇匀,暗处放置10min,然后加150mL蒸馏水并加入3mL 0.5%淀粉溶液,用0.1000mol/L Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液30.00mL,则上述产品中(NH4)2Cr2O7的纯度为______。(假定杂质不参加反应,已知:①Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,I2+2S2O32-=2I-+S4O62-;②(NH4)2Cr2O7的摩尔质量为252g/mol)。
查看答案和解析>>
科目:高中化学 来源: 题型:
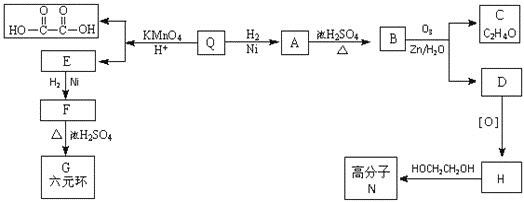
【题目】常见有机物间的转化关系如图所示(以下变化中,某些反应条件及产物未标明)。A是天然有机高分子化合物,D是一种重要的化工原料。在相同条件下,G蒸气密度是氢气的44倍。
(1)D中官能团的名称:______________________________________。
(2)C和E反应的化学方程式:________________________。
(3)检验A转化过程中有B生成,先中和水解液,再需要加入的试剂是________________________________。
(4)某烃X的相对分子质量是D、F之和,分子中碳与氢的质量之比是5∶1。下列说法正确的是________(填字母)。
A.X 不溶于水,与甲烷互为同系物
B.X性质稳定,高温下不会分解
C.X不存在含有3个甲基的同分异构体
D.X可能和溴水发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d 四种短周期元素在周期表中的位置如图所示,a 和 b 分别位于周期表的第 2 列和第 13 列, 下列叙述正确的

A.离子半径 b>d
B.b 可以和强碱溶液发生反应
C.c 的氢化物空间结构为三角锥形
D.a 的最高价氧化物对应水化物是强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿色化学又称环境友好化学,它的主要特点之一是提高原子的利用率,使原料中所有的原子全部 转化到产品中,实现“零排放”。下列反应符合绿色化学这一特点的是
A. 工业冶炼 Fe2O3+3CO ![]() 2Fe+3CO2
2Fe+3CO2
B. 用生石灰制熟石灰 CaO+H2O=Ca(OH)2
C. 实验室制取二氧化碳 CaCO3+2HCl=CaCl2+H2O+CO2↑
D. 实验室制取氢气 Zn+H2SO4=ZnSO4+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中和热的测定是高中重要的定量实验。取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于下图所示的装置中进行中和热的测定实验,回答下列问题:

(1)从上图实验装置看,其中尚缺少的一种玻璃用品是__________,除此之外,装置中的一个明显错误是___________________________________。
(2)为保证该实验成功该同学采取了许多措施,如图的碎纸条的作用在于_________。
(3)若改用60mL 0.25mol·L-1 H2SO4和50mL 0.55mol·L-1 NaOH溶液进行反应与上述实验相比,所放出的热量_______(填“相等”“不相等”),若实验操作均正确,则所求中和热__________(填“相等”“不相等”)
(4)倒入NaOH溶液的正确操作是:________。(从下列选出)
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(5)实验数据如下表:①请填写下表中的空白:
温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | ___________ |
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | ||
②近似认为0.55 mol/L NaOH溶液和0.25 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热ΔH=_________。(提示:ΔH=-![]() ,保留一位小数)。
,保留一位小数)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)________。
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
(6)如果用含0.5mol Ba(OH)2的稀溶液与足量稀硫酸溶液反应,反应放出的热____57.3 kJ(填“大于”、“小于”或“等于”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com