
【题目】下列反应中,属于氧化还原反应且属于离子反应的是
A. 2Na2O2+2CO2 = 2Na2CO3+O2 B. CO2+Ca(OH)2== CaCO3↓+H2O
C. Fe2O3+3CO![]() 2Fe+3CO2 D. 2Na+2H2O==2NaOH+H2↑
2Fe+3CO2 D. 2Na+2H2O==2NaOH+H2↑
【答案】D
【解析】
在水溶液中进行,有离子互换的反应为离子反应,反应前后元素有化合价变化的反应为氧化还原反应。
A项、过氧化钠与二氧化碳的反应中O元素化合价发生变化,属于氧化还原反应,反应不是在水溶液中进行,没有离子参加,不属于离子反应,故A错误;
B项、二氧化碳与氢氧化钙反应中没有元素的化合价变化,不属于氧化还原反应,故B错误;
C项、氧化铁与一氧化碳高温下的反应中铁元素和碳元素化合价发生变化,属于氧化还原反应,反应不是在水溶液中进行,没有离子参加,不属于离子反应,故C错误;
D项、钠与水反应中钠元素和氢元素化合价发生变化,属于氧化还原反应,反应是在水溶液中进行,有离子生成,属于离子反应,故D正确。
故选D。


科目:高中化学 来源: 题型:
【题目】已知两个羟基同时连在同一碳原子上的结构是不稳定的,它要发生脱水反应:

现有分子式为C9H8O2X2(X为一未知元素)的物质M,可在一定条件下发生上述一系列反应
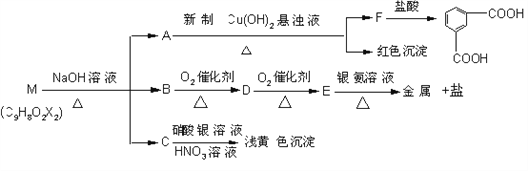
试回答下列问题:
(1)X为____________________(填元素符号);
(2)上述转化中其中属于氧化反应的共有_______步(填数字);M与NaOH溶液共热反应的所属类型是_______________ 反应。
(3)M的结构简式为 ________________________________
(4)写出下列反应的化学方程:
E和银氨溶液反应的化学方程式:_______________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究+6价铬盐不同条件下微粒存在形式及氧化性,某小组同学进行如下实验:
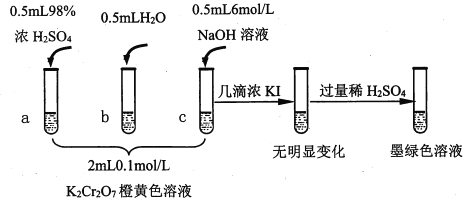
已知:Cr2O72- (橙色)+H2O![]() 2CrO42-(黄色)+2H+ △H= +13.8 kJ/mol,+6价铬盐在一定条件下可被还原为Cr3+,Cr3+在水溶液中为绿色。
2CrO42-(黄色)+2H+ △H= +13.8 kJ/mol,+6价铬盐在一定条件下可被还原为Cr3+,Cr3+在水溶液中为绿色。
(1)试管c和b对比,推测试管c的现象是________。
(2)试管a和b对比,a中溶液橙色加深。甲认为温度也会影响平衡的移动,橙色加深不一定是c(H+)增大影响的结果;乙认为橙色加深一定是c(H+)增大对平衡的影响。你认为是否需要再设计实验证明?____(“是”或“否”),理由是_________________________________。
(3)对比试管a、b、c的实验现象,得到的结论是________________。
(4)试管c继续滴加KI溶液、过量稀H2SO4,分析上图的实验现象,得出的结论是_______;写出此过程中氧化还原反应的离子方程式________________。
(5)小组同学用电解法处理含Cr2O72-废水,探究不同因素对含Cr2O72-废水处理的影响,结果如下表所示(Cr2O72-的起始浓度,体积、电压、电解时间均相同)。
实验 | ⅰ | ⅱ | ⅲ | ⅳ |
是否加入Fe2(SO4)3 | 否 | 否 | 加入5g | 否 |
是否加入H2SO4 | 否 | 加入1mL | 加入1mL | 加入1mL |
电极材料 | 阴、阳极均为石墨 | 阴、阳极均为石墨 | 阴、阳极均为石墨 | 阴极为石墨,阳极为铁 |
Cr2O72-的去除率/% | 0.922 | 12.7 | 20.8 | 57.3 |
①实验ⅱ中Cr2O72-放电的电极反应式是________________。
②实验ⅲ
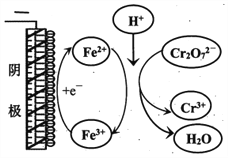
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的铝粉、氧化铝、氧化镁的混合物加入到300mL4mol/L的稀硫酸中,生成标准状况下6.72L气体。向反应后的溶液中滴加一定物质的量浓度的KOH溶液时,所得沉淀的物质的量(mol)与滴加KOH溶液的体积(mL)之间的关系如图所示:

(1)OA对应反应的离子方程式为________________,BC对应反应的离子方程式为_________________;
(2)c(KOH)=_________mol/L,混合物中氧化铝的物质的量为_____mol;
(3)A点对应的数值为_______;
(4)在中学阶段,实验室里检验B点对应的溶液中的阳离子时,所观察到的现象是___________。
(5)向C点对应的溶液中通入足量的CO2所发生反应的离子方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)NA表示阿伏加德罗常数的数值.46g NO2和N2O4的混合气体中含有_____NA个氧原子;2L0.6 mol·L1 Fe(NO3)3溶液中含_____NA个NO3—离子.
(2)三氟化氮(NF3)是一种气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3。
①写出该反应的化学方程式_________________________________
②三氟化氮可由氨气和氟气反应得到:4NH3+3F2NF3+3NH4F;据题意推测NF3,F2,NO三种气体中,氧化性由强到弱的顺序为________________________
(3)H2C2O4溶液和KMnO4酸性溶液可发生反应:___H2C2O4+___MnO4﹣+___H+→___CO2↑+___Mn2++___H2O,反应中每生成标况下4.48L CO2气体,外电路中通过的电子的物质的量为___________mol.
(4)氨和联氨(N2H4)是氮的两种常见化合物,制备联氨可用丙酮为催化剂,将次氯酸钠与氨气反应,该反应中还原剂与氧化剂的物质的量之比为2∶1,写出该反应的化学方程式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】使一镁铝合金粉末在过量稀H2SO4中溶解,在所得溶液中加入NaOH溶液,生成沉淀的质量W和加入NaOH溶液的体积V的关系如图所示,则该合金中镁和铝的物质的量之比为

A. 1∶1 B. 2∶3 C. 8∶9 D. 4∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气用于自来水的杀菌消毒,但在消毒时会产生一些负面影响,因此人们开始研究一些新型自来水消毒剂。某学习小组查阅资料发现NCl3可作为杀菌消毒剂,该小组利用如图所示的装置制备NCl3,并探究NCl3的漂白性。NCl3的相关性质如下:
物理性质 | 制备原理 | 化学性质 |
黄色油状液体,熔点为-40 ℃,沸点为 71 ℃,不溶于冷水,易溶于有机溶剂,密度为 1.65 g·mL-1 | Cl2与NH4Cl水溶液在低温下反应 | 95 ℃ 爆炸,热水中发生水解 |

回答下列问题:
(1)根据实验目的,接口连接的顺序为1-________-________-2-3-6-7-________-________-____。
(2)C装置中盛放的试剂为饱和食盐水,E装置中盛放的试剂为____________________。
(3)A装置中发生反应的离子方程式为_________________________________________。
(4)B装置中发生反应的化学方程式为___________________________________,当B装置蒸馏烧瓶中出现较多油状液体后,关闭接口2处的活塞,控制水浴加热的温度为 __________________。
(5)当E装置的锥形瓶内有黄色油状液体出现时,用干燥、洁净的玻璃棒蘸取该液体滴到干燥的红色石蕊试纸上,不褪色;若取该液体滴入热水中,片刻后取该热水再滴到干燥的红色石蕊试纸上,先变蓝后褪色,结合反应方程式解释该现象: _____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O。取一定量的浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为22.4 L。
MnCl2+Cl2↑+2H2O。取一定量的浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为22.4 L。
请回答下列问题:
(1)参加反应的二氧化锰的质量为____________。
(2)反应中被氧化的HCl的物质的量为 ____________。
(3)实验室备用的浓盐酸质量分数为36.5%,密度为1.19g·cm-3,请计算出该浓盐酸的物质的量浓度______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com