
【题目】下列关于2—环己基丙烯(![]() )和2—苯基丙烯(
)和2—苯基丙烯(![]() )的说法中正确的是( )
)的说法中正确的是( )
A.二者均可使溴水、高锰酸钾褪色,且褪色原理相同
B.2—苯基丙烯分子中所有碳原子一定共平面
C.二者可与足量的氢气在一定条件下反应得到同一种产物,此产物的一氯代物有5种
D.二者可以通过加成聚合反应形成高分子化合物
科目:高中化学 来源: 题型:
【题目】某蓄电池放电、充电时的反应为:Fe+Ni2O3+3H2O![]() Fe(OH)2+2Ni(OH)2 下列推断中正确的是( )
Fe(OH)2+2Ni(OH)2 下列推断中正确的是( )
放电时,Fe为正极,Ni2O3为负极
②充电时,阴极上的电极反应式是:Fe(OH)2+2e-===Fe+2OH-
③充电时,Ni(OH)2为阳极
④该蓄电池的电极必须是浸在某种碱性电解质溶液中
A.①②③ B.②③④ C.①②④ D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.使用催化剂能够降低化学反应的反应热△H
B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)的ΔH=+2×283.0kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和NH3.H2O反应的中和热ΔH=2(-57.3)kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,向2 L的密闭容器中充入一定量的A和B,发生反应:A(g)+B(g) ![]() C(s)+xD(g) ΔH>0,容器中A、B、D的物质的量随时间的变化如图所示。下列说法正确的是( )
C(s)+xD(g) ΔH>0,容器中A、B、D的物质的量随时间的变化如图所示。下列说法正确的是( )
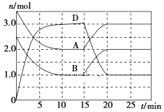
A.反应在前10 min内的平均反应速率v(D)=0.3mol·L-1·min-1
B.若平衡时保持温度不变,压缩容器体积,平衡向逆反应方向移动,平衡常数K值减小
C.反应至15min时,其他条件不变,改变的条件可能是缩小容器体积
D.反应至15min时,其他条件不变,改变的条件可能是降低反应体系温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水泥是重要的建筑材料。水泥熟料的主要成分为CaO、SiO2,并含有一定量的铁、铝和镁等金属的氧化物。实验室测定水泥样品中钙含量的过程如图所示:
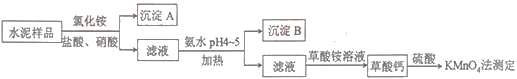
回答下列问题:
(1)沉淀A的主要成分是__。
(2)在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸。加入硝酸的目的是__,请写出相应的离子方程式:__。
(3)草酸钙沉淀经稀H2SO4处理后,用KMnO4标准溶液滴定,通过测定草酸的量可间接获知钙的含量,实验中称取0.400g水泥样品,滴定时消耗了0.0500molL-1KMnO4溶液36.00mL。
①请配平此滴定过程中的反应。
___MnO![]() +___H++___H2C2O4——___Mn2++___CO2+___H2O
+___H++___H2C2O4——___Mn2++___CO2+___H2O
②求该水泥样品中钙的质量分数为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】仅用下表提供的用品(夹持仪器和试剂任选)能实现相应实验目的的是( )
选项 | 实验目的 | 仪器 |
A | 从食盐水中获得NaCl晶体 | 坩埚、玻璃棒、酒精灯、泥三角 |
B | 除去氢氧化铝胶体中的泥沙 | 半透膜、烧杯、玻璃棒 |
C | 用0.1000mol/L盐酸测定未知浓度的NaOH溶液浓度 | 碱式滴定管、酸式滴定管、锥形瓶、胶头滴管、烧杯 |
D | 中和热的测定 | 烧杯、温度计、环形玻璃搅拌棒、泡沫塑料、硬纸板 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业烟气中含有CO、CO2、N2、SO2等气体,用Na2SO3溶液吸收并回收SO2的过程如下图所示。
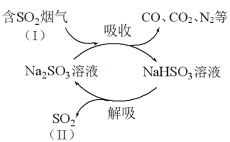
(1)SO2的浓度:I________II(填“>”或“<”)。
(2)在这个过程中可以循环使用的物质是________。
(3)上述吸收过程中主要反应的化学方程式是________。
(4)解吸过程需要加热,在这个过程中常伴有少量SO42-产生。
① 证明产物中含SO42-的实验方法是:取少量解吸产物的溶液,________(填操作和现象)。
② 产生SO42-的原因是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀而被广泛用作高新科技材料,被誉为“未来金属”。以钛铁矿(主要成分钛酸亚铁)为主要原料冶炼金属钛同时获得副产品甲的工业生产流程如下。请回答下列问题。
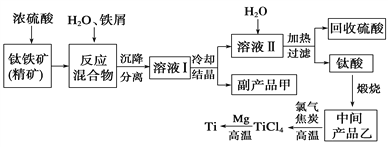
(1)钛酸亚铁(用R表示)与碳在高温下反应的化学方程式为2R+C═2Fe+2TiO2+CO2↑,钛酸亚铁的化学式为_______________;钛酸亚铁和浓H2SO4反应的产物之一是TiOSO4,反应中无气体生成,该反应的化学方程式为____________________。
(2)上述生产流程中加入铁屑的目的是_________________________,此时溶液Ⅰ中含有Fe2+、TiO2+和少量Mg2+等阳离子。常温下,其对应氢氧化物的Ksp如下表所示。
氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
Ksp | 8.0×10-16 | 1.0×10-29 | 1.8×10-11 |
①常温下,若所得溶液中Mg2+的物质的量浓度为0.0018mol/L,当溶液的pH等于_______时,Mg(OH)2开始沉淀。
②若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量白色沉淀,该反应的离子方程式为___________________________________________________________。
(3)中间产品乙与焦炭、氯气在高温下发生反应制取TiCl4的方程式为________。Mg还原TiCl4过程中必须在1070K的温度下进行,你认为还应该控制的反应条件是_________。除去所得金属钛中少量的金属镁可用的试剂是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在 5 L 的恒容密闭容器中发生反应N2(g)+3H2(g)2NH3(g)。反应过程中的部分数据如下表所示:
n/mol t/min | N(N2) | N(H2) | N(NH3) |
0 | a | 24 | 0 |
5 | 13 | 6 | |
10 | 12 | ||
15 | 8 |
下列说法正确的是
A.N2 的初始浓度为16 mol·L1
B.0~5 min 用H2表示的平均反应速率为0.24 mol·L1·min1
C.平衡状态时,c(N2)=2.6 mol·L1
D.N2 的平衡转化率为 25%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com