
【题目】在一定条件下,如图所示装置可实现有机物的电化学储氢,将10 mol由苯和环已烷组成的混合气体通入反应器中,下列说法不正确的是

A.N为电源的正极
B.H+从右向左移动
C.D电极上的电极反应式为![]()
D.苯的转化率为50%
【答案】C
【解析】
根据图示,在电极D,苯转化为环己烷,为还原反应,苯发生还原反应得到电子,电极D为阴极,则M为负极,N为正极,电极E为阳极,在阳极,H2O失去电子,生成O2,据此分析解答。
A.根据分析N为电源的正极,A正确,不选;
B.在电解池中,H+向阴极移动,D为阴极,H+从右向左移动,B正确,不选;
C.根据图示,苯转化为环己烷,为还原反应,应得到电子,电解质溶液为酸性,电极方程式为![]() ,C错误,符合题意;
,C错误,符合题意;
D.根据分析,电极E生成O2,电极方程式为2H2O-4e-=O2↑+4H+,生成1.8molO2,转移7.2mol电子,根据电极D的反应方程式,反应了![]() 苯,10mol混合气体,苯的物质的量分数为24%,则苯的物质的量为2.4mol,反应了1.2mol,其转化率为50%,D正确,不选;
苯,10mol混合气体,苯的物质的量分数为24%,则苯的物质的量为2.4mol,反应了1.2mol,其转化率为50%,D正确,不选;
答案选C。


科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.使pH试纸变蓝的溶液中:![]() 、Na+、Cl-、ClO-
、Na+、Cl-、ClO-
B.1.0 mol·L-1的HNO3溶液中:K+、[Ag(NH3)2]+、Cl-、![]()
C.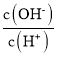 =1的溶液中:Fe2+、
=1的溶液中:Fe2+、![]() 、Al3+、I-
、Al3+、I-
D.0.1 mol·L-1的NH4HCO3溶液中:K+、Na+、![]() 、Cl-
、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用含A、B两种金属单质的粉末状混合物进行如下实验,其转化关系如下图所示(部分反应物和生成物未列出),其中E为白色胶状沉淀,I为红褐色沉淀。(此转化关系中所用的试剂都是足量的)

(1)写出下列物质的化学式:F____________,G________________。
(2)将混合物中两种金属分离开的最简单的方法是___________。
(3)D→E的转化中,加入过量的X可能是_____________________。
A.饱和NaCl溶液 B.NaOH溶液 C.氨水 D.Ba(OH)2溶液
(4)写出下列转化的化学方程式:
A→C:______________________________________________;
H→I:_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S与CO2高温下发生反应:H2S(g)+CO2(g) ![]() COS(g)+H2O(g)。在610 K时,将0.10 mol CO2与0.40 molH2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
COS(g)+H2O(g)。在610 K时,将0.10 mol CO2与0.40 molH2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
(1)H2S的平衡转化率α1=________%,反应平衡常数K=___________________。
(2)在620K重复实验,平衡后水的物质的量分数为0.03,H2S的转化率α2________α1,该反应的ΔH____0(填“>”“<”或“=”)。
(3)向反应器中再分别充入下列气体,能使H2S转化率增大的是______(填标号)。
A.H2S B.CO2 C.COS D.N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是由常见元素组成的一些单质及其化合物之间的转化关系图。各方框表示有关的一种反应物或生成物(部分物质已经略去)。其中A、B、D在常温下均为无色无味的气体,C是能使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体。

(1)写出C→E的化学方程式: 。
(2)实验室常用加热两种固体混合物的方法制备物质C,其化学方程式为: ,干燥C常用 (填写试剂名称)。
(3)E物质遇到D物质时,会观察到 现象,若用排水法收集F,则最终集气瓶中收集到的气体为 (填写物质的化学式)。
(4)写出A→D的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A、B、C、D 4种物质混合,发生如下反应:aA+bB![]() cC(s)+dD,当反应进行一定时间后,测得A减少了4n mol,B减少了2n mol,C增加了6n mol,D增加了4n mol,此时达到化学平衡。
cC(s)+dD,当反应进行一定时间后,测得A减少了4n mol,B减少了2n mol,C增加了6n mol,D增加了4n mol,此时达到化学平衡。
(1)该化学方程式各物质的化学计量数为a=____、b=____、c=_____、d=____。
(2)若只改变压强,反应速率发生变化,但平衡不发生移动,该反应中各物质的聚集状态: A_________、B_______、D________。
(3)若只升高温度,反应一段时间后,测知4种物质其物质的量又达到相等,则该反应为______(填“放热”或“吸热”)反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上生产铬单质涉及的反应如下:
Na2Cr2O7+2C![]() Cr2O3+Na2CO3+CO↑
Cr2O3+Na2CO3+CO↑
Cr2O3+2Al![]() 2Cr+Al2O3
2Cr+Al2O3
(1) Cr基态原子的核外电子排布式为________。

(2) Na、O、C的第一电离能从大到小的顺序为________。
(3) 与CO![]() 互为等电子体的一种分子为________(填化学式)。
互为等电子体的一种分子为________(填化学式)。
(4) Cr2O3具有两性,溶于NaOH溶液形成配合物Na[Cr(OH)4]。
Na[Cr(OH)4]中配体的化学式为____________,1 mol该配合物中含σ键数目为_________。
(5) 合金CrAl晶体的晶胞如右图所示,写出该合金的化学式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无机非金属材料、金属材料和有机高分子材料并称为三大材料,是发展高新技术的基石,在未来科技发展中发挥着重要的作用。
(1)Nierite是一种高熔点高硬度的陶瓷材料。Nierite的摩尔质量为140 g/mol,其中硅元素的质量分数为60%。已知1 mol NH3与足量的SiCl4充分反应后可得到35 g Nierite与3 mol HCl气体。Nierite的化学式为___________。
(2)K金是常见的贵金属材料,除黄金外,还含有银、铜中的一种或两种金属。为测定某18K金样品的组成,将2.832 g样品粉碎后投入足量的浓硝酸中,固体全部溶解后,收集到NO2和N2O4的混合气体224 mL(折算至标准状况,下同),将该混合气体与84 mL O2混合后缓缓通入水中,恰好被完全吸收。
填写该18K金的成分表(精确至0.01%,若不含该金属则填0)。
18K金成分 | Au | Ag |
含量(质量分数) | 75.00% | _________ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com