
【题目】下列化合物中,既显酸性,又能发生酯化反应和消去反应的是( )
A.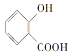
B.CH3CH=CHCOOH
C.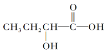
D.![]()
【答案】C
【解析】
A. 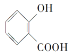 分子中含有-COOH具有酸性,含有-COOH及-OH,能够发生酯化反应;由于羟基、羧基连接在苯环上,具有特殊的稳定性,不能发生消去反应,A不符合题意;
分子中含有-COOH具有酸性,含有-COOH及-OH,能够发生酯化反应;由于羟基、羧基连接在苯环上,具有特殊的稳定性,不能发生消去反应,A不符合题意;
B. CH3CH=CHCOOH含有羧基-COOH,具有酸性,能够发生酯化反应,但不能发生消去反应,B不符合题意;
C. 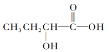 含有羧基,具有酸性;含有羧基和醇羟基,能够发生酯化反应;由于羟基连接的C原子的邻位C原子上含有H原子,所以可以发生消去反应,C符合题意;
含有羧基,具有酸性;含有羧基和醇羟基,能够发生酯化反应;由于羟基连接的C原子的邻位C原子上含有H原子,所以可以发生消去反应,C符合题意;
D. ![]() 含有醇羟基,能够发生酯化反应,由于羟基连接的C原子的邻位C原子上含有H原子,所以可以发生消去反应,但无羧基,因此没有酸性,D不符合题意;
含有醇羟基,能够发生酯化反应,由于羟基连接的C原子的邻位C原子上含有H原子,所以可以发生消去反应,但无羧基,因此没有酸性,D不符合题意;
故合理选项是C。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列说法正确的是
A.标准状况下,0.1mol Cl2溶于水,转移的电子数目为0.1NA
B.标准状况下,2.24L NO和2.24L O2混合后气体分子数为0.15 NA
C.0.1mol Na2O2与足量的潮湿的二氧化碳反应转移的电子数为0.1NA
D.加热条件下,1mol Fe投入足量的浓硫酸中,生成NA个SO2分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物C常用于食品行业。已知9.0gC在足量O2中充分燃烧,将生成的混合气体依次通过足量的浓硫酸和碱石灰,分别增重5.4g和13.2g,经检验剩余气体为O2。
(1)C分子的质谱图如图所示,从图中可知其相对分子质量是__,则C的分子式是__。
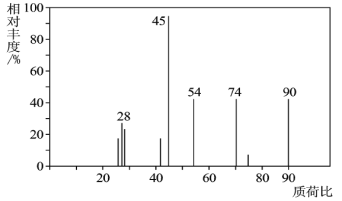
(2)C能与NaHCO3溶液发生反应,C一定含有的官能团是__。
(3)C分子的核磁共振氢谱有4个峰,峰面积之比是1:1:1:3,则C的结构简式是__。
(4)0.1molC与1.0mol/L的氢氧化钠溶液反应,需溶液的体积是__mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子反应方程式书写正确的是
A.往稀盐酸中逐滴加入Na2CO3溶液,开始时:H++CO32-=HCO3-
B.草酸(H2C2O4)溶液中加入酸性KMnO4溶液:2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O
C.往少量澄清石灰水中加入Ca(HCO3)2溶液:Ca2++OH-+HCO3-=CaCO3↓+H2O
D.用HI溶液溶解Fe2O3固体:Fe2O3+6H+=2Fe3++3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】机动车排放的污染物主要有碳氢化合物、一氧化碳和氮氧化物等。
I.汽油燃油车上安装三元催化转化器,可有效降低汽车尾气污染。
(1)已知: C(s)+O2(g) = CO2(g) △H1 = 393.5kJ·mol1
2C(s)+O2(g) = 2CO(g) △H2 = 221.0 kJ·mol1
N2(g)+O2(g) = 2NO(g) △H 3 =+180.5 kJ·mol1
CO和NO两种尾气在催化剂作用下生成N2的热化学方程式是_________________________。
(2)研究CO和NO的催化反应,用气体传感器测得在某温度下、一定体积的密闭容器中,不同时间NO和CO浓度如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/(______)4mol·L1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(CO)/(______)3mol·L1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
① 前4 s内的平均反应速率υ(CO) =______mol·L1·s1。
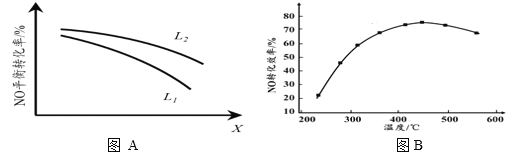
② L、X可分别代表压强或温度。下图A表示L一定时,NO(g)的平衡转化率随X的变化关系。X代表的物理量是______。判断L1、L2的大小关系,并简述理由:______________________________。
(3)实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2) ·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数______(填“>”、“
②若在2 L的密闭容器中充入1 mol CO和1 mol NO,在一定温度下达到平衡时,CO的转化率为40%,则k正︰k逆 =___________。(保留一位小数)
II. 有人利用反应C(s)+2NO(g) ![]() N2(g)+CO2(g) ΔH = 34.0 kJ·mol1,用活性炭对NO进行吸附。现在密闭容器中加入足量的C和一定量的NO气体并在催化剂作用下发生反应,经相同时间测得NO的转化率随温度的变化如图B所示。由图可知最高转化率对应温度为450℃。低于450℃时,NO的转化率是不是对应温度下的平衡转化率及判断理由是________________________;
N2(g)+CO2(g) ΔH = 34.0 kJ·mol1,用活性炭对NO进行吸附。现在密闭容器中加入足量的C和一定量的NO气体并在催化剂作用下发生反应,经相同时间测得NO的转化率随温度的变化如图B所示。由图可知最高转化率对应温度为450℃。低于450℃时,NO的转化率是不是对应温度下的平衡转化率及判断理由是________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生成水的能量关系如图所示:下列说法不正确的是
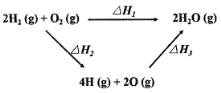
A.△H2>0
B.若2H2(g)+O2(g)=2H2O(l) △H4,则△H4<△H1
C.一定条件下,气态原子生成1 mol H-O放出a kJ热量,则该条件下△H3=-4akJ/mol
D.△H1+△H2+△H3=0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水电池常用在海上浮标等助航设备中,其示意图如图所示。电池反应为2Li+2H2O=2LiOH+H2↑。电池工作时,下列说法错误的是( )
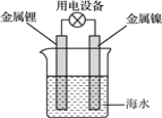
A.金属锂作负极
B.电子从锂电极经导线流向镍电极
C.海水作为电解质溶液
D.可将电能转化为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu2O是一种半导体材料,基于绿色化学理念设计的一种制取Cu2O的电解池示意图如下,电池总反应为2Cu+H2O![]() Cu2O+H2↑。下列说法正确的是
Cu2O+H2↑。下列说法正确的是

A.石墨电极上产生氢气
B.铜电极发生还原反应
C.铜电极接直流电源的负极
D.当有0.1mol电子转移时,有0.1mol Cu2O生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在工业上有重要用途。请回答下列有关问题:
(1)已知N2(g)+O2(g)=2NO(g) ΔH =+180.5kJ·mol-1,N2(g)+3H2(g) ![]() 2NH3(g)ΔH =-92.4kJ·mol-1,2H2(g)+O2(g)=2H2O(g) ΔH =-483.6kJ·mol-1,写出氨气经催化氧化完全生成一氧化氮和水蒸气的热化学方程式为_________
2NH3(g)ΔH =-92.4kJ·mol-1,2H2(g)+O2(g)=2H2O(g) ΔH =-483.6kJ·mol-1,写出氨气经催化氧化完全生成一氧化氮和水蒸气的热化学方程式为_________
(2)在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g) ![]() 2NH3(g),在恒温恒压下判断该反应达到化学平衡状态的依据是______(填序号);
2NH3(g),在恒温恒压下判断该反应达到化学平衡状态的依据是______(填序号);
A.2v(H2)(正)=3v(NH3)(逆) B.2v(N2) (正)=v(H2) (逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
(3)在有氧条件下,新型催化剂M能催化![]() 与
与![]() 生成
生成![]() 。将一定比例的
。将一定比例的![]() 、
、![]() 和
和![]() 的混合气体,匀速通入装有催化剂M的反应器中反应(装置见图)。
的混合气体,匀速通入装有催化剂M的反应器中反应(装置见图)。
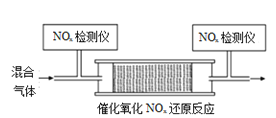
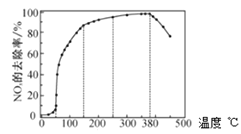
反应相同时间![]() 的去除率随反应温度的变化曲线如图所示,在
的去除率随反应温度的变化曲线如图所示,在![]() 范围内随着温度的升高,
范围内随着温度的升高,![]() 的去除率先迅速上升后上升缓慢,迅速上升段是催化剂活性随温度升高增大,与温度升高共同使
的去除率先迅速上升后上升缓慢,迅速上升段是催化剂活性随温度升高增大,与温度升高共同使![]() 去除反应速率迅速增大,上升阶段缓慢主要是____________;当反应温度高于
去除反应速率迅速增大,上升阶段缓慢主要是____________;当反应温度高于![]() 时,
时,![]() 的去除率迅速下降的原因可能是_________。
的去除率迅速下降的原因可能是_________。
(4)如图为利用肼![]() —空气燃料电池电解硫酸铜溶液的示意图。
—空气燃料电池电解硫酸铜溶液的示意图。
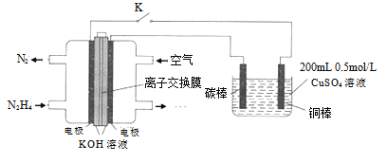
左图负极反应式为:___________。当上图阴极上放出2.24L气体![]() 标准状况
标准状况![]() 时,图中硫酸铜溶液的pH=______(溶液体积变化忽略不计)。
时,图中硫酸铜溶液的pH=______(溶液体积变化忽略不计)。
(4)工业上生产尿素的化学方程式为:2NH3(g)+CO2(g) ![]() CO(NH2)2(s)+H2O(l)。在T℃,体积为4L的密闭容器中,通入6mol NH3和3mol CO2 。10min反应达到平衡,达到平衡时,c(NH3)=0.5mol·L-1。则10min内的平均反应速率υ(CO2)=_______mol·L-1·min-1。若此时保持T℃和平衡时容器的压强不变,再向体积可变的容器中充入3mol NH3,则此时反应的v正____ v逆(填“>”“<”或“=”)。
CO(NH2)2(s)+H2O(l)。在T℃,体积为4L的密闭容器中,通入6mol NH3和3mol CO2 。10min反应达到平衡,达到平衡时,c(NH3)=0.5mol·L-1。则10min内的平均反应速率υ(CO2)=_______mol·L-1·min-1。若此时保持T℃和平衡时容器的压强不变,再向体积可变的容器中充入3mol NH3,则此时反应的v正____ v逆(填“>”“<”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com