
【题目】下列离子反应方程式书写正确的是
A.往稀盐酸中逐滴加入Na2CO3溶液,开始时:H++CO32-=HCO3-
B.草酸(H2C2O4)溶液中加入酸性KMnO4溶液:2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O
C.往少量澄清石灰水中加入Ca(HCO3)2溶液:Ca2++OH-+HCO3-=CaCO3↓+H2O
D.用HI溶液溶解Fe2O3固体:Fe2O3+6H+=2Fe3++3H2O
科目:高中化学 来源: 题型:
【题目】某探究性学习小组设计如图所示装置分别进行如下探究实验,请回答下列问题:
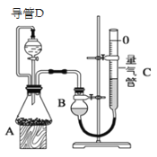
实验 | 药品 | 制取气体 | 量气管中的液体 |
Ⅰ | Cu、稀HNO3 | H2O | |
Ⅱ | Na OH固体、浓氨水 | NH3 | |
Ⅲ | 镁铝合金、足量NaOH溶液 | H2 | H2O |
(1)实验I通过收集并测量NO气体的体积来探究铜样品的纯度,有的同学认为该实验设计不可行,主要原因是__________________________;
(2)实验Ⅱ中量气管中的液体最好是_______(填字母编号,下同)
A.NaOH溶液B.氨水C.煤油D.氯化铵溶液
实验剩余的NH3需吸收处理,以下各种尾气吸收装置中,不能防止倒吸的是________;
(3)①写出实验Ⅲ中涉及的离子反应方程式_________________________;
②反应前,先对量气管进行第一次读数。读数时,应注意的操作是________________,并使视线与凹液面最低处相平;反应后,待装置温度冷却到室温时,再对量气管进行第二次读数。
③实验Ⅲ在25℃、1.01×105Pa条件下获得以下数据:
编号 | 镁铝合金质量 | 量气管第一次读数 | 量气管第二次读数 |
① | 1.0g | 10.0mL | 376.6mL |
② | 1.0g | 10.0mL | 364.7mL |
③ | 1.0g | 10.0mL | 377.0mL |
根据上述数据,计算出镁铝合金中铝的质量分数为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图Ⅰ~Ⅳ所示,下列有关说法正确的是( )
A.实验Ⅰ可以根据澄清石灰水是否变浑浊鉴别碳酸钠和碳酸氢钠固体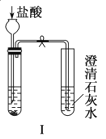
B.实验Ⅱ验证碳酸钠和碳酸氢钠的稳定性,则小试管B中装入的固体是碳酸钠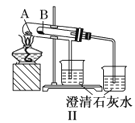
C.与实验Ⅲ相比,实验Ⅱ的优点是可以用一套装置同时进行两个对比实验,而Ⅲ不行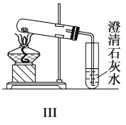
D.实验Ⅳ分别测定等浓度碳酸钠和碳酸氢钠溶液的pH,碳酸氢钠溶液pH大于碳酸钠溶液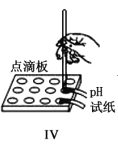
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A(g)和2 mol B(g)在2 L的恒容密闭容器中混合并在一定条件下发生反应:2A(g)+B(g) 2C(g) ΔH<0,反应2 s后测得C的浓度为0.6 mol·L-1。下列说法正确的是
A.2 s后物质A的转化率为70%
B.当各物质浓度满足c(A)=2c(B)=c(C)时,该反应达到了平衡状态
C.达到平衡状态时,增加A的物质的量,A和B的转化率都提高
D.达到平衡状态时,升高温度,平衡逆向移动,同时化学平衡常数K减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2的减排已经引起国际社会的广泛关注,近日我国科学家实现了CO2高选择性、高稳定性加氢合成甲醇(CH3OH)。回答下列问题:
(1)CH3OH的摩尔质量是__gmol-1。
(2)2molH2O中所含原子的物质的量为__mol。
(3)__g的氢气中所含H原子的数目与1molCH3OH相同。
(4)含0.1NA个O的CO2中有__个电子,标况下该CO2的体积为__L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证氧化性:Cl2>Fe3+>SO2,某小组用图所示装置进行实验(夹持仪器和甲中加热装置已略,气密性已检验)。
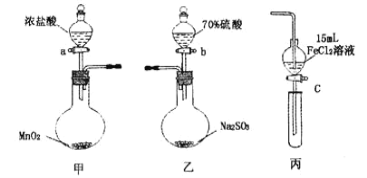
实验步骤:
(1)在甲装置中,打开活塞a,加热,待装置中充满黄绿色气体时,与丙装置连接。
(2)当丙装置中FeC12溶液变黄时,停止加热。
(3)打开活塞c,使约2mL的溶液滴入试管中,检验溶液中的离子。
(4)在乙装置中,打开活塞b,待空气排尽后,将乙中产生的气体通入上述丙装置变黄后的溶液中,一段时间后停止。
(5)更新丙中试管,打开活塞c,使约2mL的溶液滴入试管中,检验溶液中的离子。
回答下列问题:
(1)乙中发生反应的化学方程式为_________。
(2)实验中,证明氧化性Fe3+>SO2的离子方程式为_________。
(3)将甲装置与丙装置连接的目的是_______。
(4)有I、II、III三组同学分别完成了上述实验,实验结果如图:

上述实验结果一定能够证明氧化性:Cl2>Fe3+>SO2的是______(用“I”、“II”、“III”代号回答)。
(5)若要用以上甲和丙装置证明氧化性为:Cl2> Fe3+> I2的结论,则步骤为:
①往丙的漏斗中加入两种试剂____、___和一种溶剂_____。
②将甲装置中产生的Cl2慢慢通入丙中,观察丙的漏斗中溶液颜色变化。
③如果观察到丙中溶液________则结论正确。
④停止通入Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气与氧气生成水的反应是氢能源应用的重要途径。下列有关说法正确的是
A. 一定温度下,反应2H2(g)+O2(g) ![]() 2H2O(g)能自发进行,该反应的ΔH<0
2H2O(g)能自发进行,该反应的ΔH<0
B. 氢氧燃料电池的负极反应为O2+2H2O+4e![]() 4OH
4OH
C. 常温常压下,氢氧燃料电池放电过程中消耗11.2 L H2,转移电子的数目为6.02×1023
D. 反应2H2(g)+O2(g) ![]() 2H2O(g)的ΔH可通过下式估算:
2H2O(g)的ΔH可通过下式估算:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为纪念迪米特里·门捷列夫发明的元素周期表诞生150周年,联合国大会宣布2019年是“国际化学元素周期表年”.元素周期表是科学界最重要的成就之一,表是元素周期表的一部分,其中每个数字序号代表一种短周期元素.
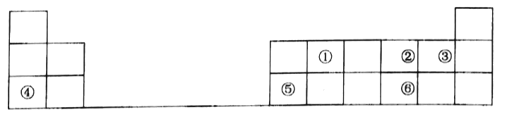
请按要求回答下列问题:
(1)将①、②和③三种元素相比较,非金属性最强的是(填元素符号)______;用原子结构解释原因,理由是:_________
(2)元素②与⑥的氢化物的稳定性顺序为________(填化学式);
(3)元素②与元素④能形成原子个数比为1:1的化合物Y,Y在常温下为固态,焰色反应为黄色,Y与①的最高价氧化物反应的化学方程式为__________
(4)元素④和元素⑤的最高价氧化物对应的水化物在溶液中相互反应的离子方程式是___
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com