
【题目】基础知识填空:
(1)酸雨的pH小于______;硅酸钠的水溶液俗称______;
(2)有以下物质:①Cu ②Al ③ C ④稀硫酸 ⑤浓硫酸 ⑥稀硝酸 ⑦浓硝酸。
加热条件下,①和④______(填“能”或者“不能”)反应;
常温下,⑤和⑦可盛装在______(选填①或②)容器中;
写出①与⑥反应的化学方程式______;
(3)实验室用MnO2与浓盐酸反应制氯气,在该反应中,氧化剂是______,如有1 mol Cl2生成,则被氧化的HCl的物质的量是______mol,转移的电子数目为______。
【答案】 5.6 水玻璃 不能 ② 3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O MnO2 2 2NA或1.204×1024
【解析】(1)酸雨的pH小于5.6;硅酸钠的水溶液俗称水玻璃,故答案为:5.6;水玻璃;
(2)根据金属活动性顺序表,加热条件下,铜与稀硫酸不能反应;常温下,浓硫酸、浓硝酸能够与铝发生钝化,可盛装在铝制容器中;铜与稀硝酸反应的化学方程式为3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,故答案为:不能;②;3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O;
(3)实验室用MnO2与浓盐酸反应制氯气的方程式为MnO2+4HCl![]() MnCl2+Cl2↑+2H2O,在该反应中,锰元素化合价降低,是氧化剂,如有1 mol Cl2生成,转移2mol电子,则被氧化的HCl的物质的量是2mol,数目为1.204×1024,故答案为:MnO2;2 ;1.204×1024。
MnCl2+Cl2↑+2H2O,在该反应中,锰元素化合价降低,是氧化剂,如有1 mol Cl2生成,转移2mol电子,则被氧化的HCl的物质的量是2mol,数目为1.204×1024,故答案为:MnO2;2 ;1.204×1024。


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】通过溶解、过滤、蒸发等操作,可将下列各组混合物分离的是( )
A.硝酸钠、氢氧化钠
B.氧化铜、二氧化锰
C.氯化钾、二氧化锰
D.硫酸铜、氢氧化钙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验设计能够成功的是( )
NaI溶液![]()
![]() 溶液变紫色→氧化性:H2O2>I2
溶液变紫色→氧化性:H2O2>I2
A. 检验亚硫酸钠试样是否变质:试样![]()
![]() 白色沉淀
白色沉淀![]() 沉淀不溶解→说明试样已变质
沉淀不溶解→说明试样已变质
B. 除去粗盐中含有的硫酸钙杂质:粗盐![]()
![]()
![]()
![]()
![]()
![]() 精盐
精盐
C. 检验某溶液中是否含有Fe2+:试样![]() 溶液颜色无变化
溶液颜色无变化![]() 溶液变红色→溶液中含有Fe2+
溶液变红色→溶液中含有Fe2+
D. 证明酸性条件H2O2的氧化性比I2强:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A为正盐,常温、常压下,B、C、D、E、G、H、I均为气体,其中D、G、H为单质,气体B能使湿润红色石蕊试纸变蓝,气体E本身为无色气体,但是与空气接触会生成一种红棕色气体I,H为黄绿色气体。F在常温下是一种无色液体。C、J的水溶液分别为两种强酸。图中反应条件(除加热外)均已略去。
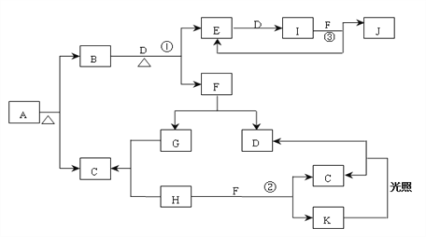
⑴写出它们的化学式: A________、C________、J________;
⑵实验室制备气体B的化学反应方程式为______;
⑶写出B+D→E+F的化学反应方程式:______;
⑷ J的浓溶液与单质Ag反应的离子方程式为:______;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用下图甲装置制取氨气并探究氨气的有关性质。


(1)装置A中烧瓶内试剂可选用________(填序号)。
a.碱石灰 b.浓硫酸 c.五氧化二磷 d.NaOH固体
(2)若探究氨气的溶解性,标准状况下,装置D中收集满氨气后,关闭K1、K2,打开K3,引发喷泉的实验操作是________________;完成喷泉实验后,装置D中充满液体,则装置D中溶液的物质的量浓度为__________。
(3)K2的导管末端需要连接氨气的吸收装置,则不能在K2的导管末端连接图乙中的________装置(填序号Ⅰ、Ⅱ、Ⅲ)。
(4)若探究氨气的还原性,需关闭K1、K3,K2连接纯净、干燥氯气的装置。
①D中氨气与氯气反应产生白烟,同时生成一种化学性质稳定气体单质,该反应可用来检验氯气管道是否有泄漏,则该反应的化学方程式为______。
②尾气可用C装置处理,若尾气中含有少量Cl2,则C装置中应盛放__________溶液(填化学式),反应的离子方程式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胶体区别于其它分散系的特征是( )
A. 胶体粒子能够发生布朗运动
B. 胶体粒子带电荷
C. 胶体粒子直径在1﹣100nm之间
D. 胶体粒子不能穿过半透膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】桶烯(Barrelene)结构简式如图所示,则下列有关说法一定正确的是

A. 0. 1mol桶烯完全燃烧需要消耗氧气22. 4L
B. 桶烯在一定条件下能发生加成反应,不能发生加聚反应
C. 桶烯二氯取代产物只有三种
D. 桶烯与苯乙烯(C6H5CH=CH2)互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s) + Pb2+(aq)![]() Sn2+(aq) + Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是
Sn2+(aq) + Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是

A.往平衡体系中加入金属铅后,c(Pb2+)增大
B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小
C.升高温度,平衡体系中c(Pb2+)增大,说明该反应ΔH>0
D.25 ℃时,该反应的平衡常数K=2.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“各能级最多容纳的电子数,是该能级原子轨道数的二倍”,支撑这结论的理论是
A. 构造原理 B. 泡利不相容原理
C. 洪特规则 D. 能量最低原理
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com