


科目:高中化学 来源: 题型:
 (1)在一体积为10L的容器中,通入一定量的CO和H2O,在 800℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,CO和H2O的物质的量浓度变化如图所示,则:
(1)在一体积为10L的容器中,通入一定量的CO和H2O,在 800℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,CO和H2O的物质的量浓度变化如图所示,则:| C.(I-)/mol?L-1 | C.(Fe3+)/mol?L-1 | v/mol?L-1?s-1 | |
| ① | 0.20 | 0.80 | 0.032k |
| ② | 0.60 | 0.40 | 0.144k |
| ③ | 0.80 | 0.20 | 0.128k |
查看答案和解析>>
科目:高中化学 来源: 题型:
 填写下列空白:
填写下列空白: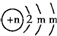 ,请回答下列问题:
,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ | ⑩ | ||||||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| V2O5 |
| △ |
| c2-c1 |
| t2-t1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、O2的能量一定高于SO2的能量 |
| B、SO2和O2的总能量一定高于SO3的总能量 |
| C、SO2的能量一定高于SO3的能量 |
| D、该反应为放热反应,但也需要一定的条件才可发生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com