
【题目】将一包由Cu、![]() 和CuO组成的混合物均分成两份:一份混合物在加热条件下与
和CuO组成的混合物均分成两份:一份混合物在加热条件下与![]() 充分反应,将固体全部转化成铜粉时固体质量减少了
充分反应,将固体全部转化成铜粉时固体质量减少了![]() ;向另一份混合物中加入
;向另一份混合物中加入![]() 溶液恰好完全反应生成
溶液恰好完全反应生成![]() 和
和![]() 假设不产生其他还原产物
假设不产生其他还原产物![]() ,这些NO和
,这些NO和![]() 标准状况
标准状况![]() 混合并通入足量水中,气体全部被吸收生成
混合并通入足量水中,气体全部被吸收生成![]() 。则该硝酸的物质的量浓度为
。则该硝酸的物质的量浓度为![]()
![]()
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
科目:高中化学 来源: 题型:
【题目】“低碳生活”是指减少能源消耗、节约资源,从而减少二氧化碳排放的生活方式。下列不符合“低碳生活”的做法是( )
A.用篮子代替塑料袋 B.经常开车上班
B.经常开车上班
C.使用节能灯泡 D.节约每一滴水
D.节约每一滴水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国电池的年市场消费量约为80亿只,其中70%是锌锰干电池,利用废旧锌锰干电池制备硫酸锌晶体(ZnSO4·7H2O)和纯MnO2的工艺如下图所示:
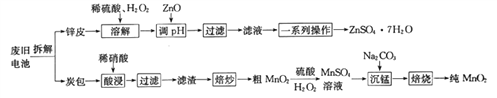
已知:
①锌皮的主要成分为Zn,含有少量Fe;炭包的主要成分为ZnCl2、NH4Cl、MnO2、碳粉等,还含有少量的 Cu、Ag、Fe 等。
②Ksp[Zn(OH)2]=2.0×10-16;Ksp[Fe(OH)2]=8.0×10-16;Ksp[Fe(OH)3]=4.0×10-38。
(1)除去炭包中碳粉的操作为_____________。
A.酸浸 B.过滤 C.焙炒 D.焙烧
(2)粗MnO2转化为MnSO4时,主要反应的离子方程式为_____________________。
(3)焙烧时发生反应的化学方程式为_____________。
(4)制备硫酸锌晶体流程中,用ZnO调节溶液pH的目的是______________________________,若溶解时不加H2O2带来的后果是____________________。
(5)“草酸钠-高锰酸钾返滴法”可测定MnO2的纯度:取agMnO2样品于锥形瓶中,加入适量稀硫酸,再加入V1mLc1mol·L-1Na2C2O4溶液(足量),最后用c2mol·L-1的KMnO4溶液滴定剩余的Na2C2O4,达终点时消耗V2 mL标准KMnO4溶液。
①MnO2参与反应的离子方程式为_____________。
②该样品中MnO2的质量分数为__________________(假定杂质不参与反应,列出表达式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.含0.2 mol H2SO4的浓硫酸和足量的铜反应,转移电子数为0.2NA
B.25 ℃时,1 L pH=13的Ba(OH)2溶液中由水电离产生的OH-的数目为0.1NA
C.15 g HCHO中含有1.5NA对共用电子对
D.常温常压下,22.4 L甲烷气体中含有的氢原子数目小于4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,有下列五种溶液:
① | ② | ③ | ④ | ⑤ |
0.1 mol·L-1 CH3COOH溶液 | 0.01mol·L-1 CH3COOH溶液 | pH=2 CH3COOH溶液 | 0.1 mol·L-1 NaOH溶液 | 0.1mol·L-1 氨水 |
回答下列问题:
(1)溶液①稀释到原来的10倍后的溶液pH______③溶液的pH(填“>”或“=”或“<”,下同),①和④两溶液中水电离出的c(H+):①_______④
(2)在相同温度时100mL ②的溶液与10mL ①的溶液相比较,下列数值前者大于后者的是_______
A 中和时所需NaOH的量 B 电离程度
C 水电离出的c(H+) D CH3COOH的物质的量
(3)用水稀释⑤时,溶液中随着水量的增加而减小的是______(填字母)。
A、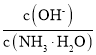 B、
B、
C、c(H+)和c(OH-)的乘积 D、 OH-的物质的量
(4)联氨(N2H4)溶于水显碱性,其原理与氨相似,但其碱性不如氨强,写出其溶于水呈碱性的离子方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物在生产、生活中广泛存在
(1)键能是气态原子形成1mol化学键释放的最低能量。已知下列化学键的键能如表所示,写出1mol气态肼(NH2-NH2)燃烧生成氮气和水蒸气的热化学方程式_________
化学键 | N≡N | O=O | N-N | N-H | O-H |
键能/(kJ/mol) | 946 | 497 | 193 | 391 | 463 |
(2)用焦炭还原NO的反应为:2NO(g)+C(s) ![]() N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
t/min | 0 | 10 | 20 | 30 | 40 |
n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(NO)(乙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
n(NO)(丙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
该反应为_____________(填“放热”或“吸热”)反应乙容器中的反应在60min时达到平衡状态,则0-60min内用NO的浓度变化表示的平均反应速率V(NO)=_________
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s) ![]() N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
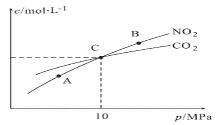
①A、B两点的浓度平衡常数关系:Kc(A)_____________Kc(B)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是_____________(填“A”或“B”或“C”)点。
③计算C点时该反应的压强平衡常数Kp(C)=____________(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2广泛用于造纸工业、污水处理等,其漂白能力是漂白粉的4~5倍。工业上用ClO2气体制NaClO2的工艺流程如图:
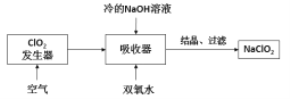
已知:NaClO2饱和溶液在低于38℃时析出NaClO23H2O,高于38℃时析出NaClO2。
下列说法不正确的是( )
A. 吸收器中生成NaClO2的离子方程式:2ClO2+2OHˉ+H2O2=2ClO2ˉ+O2+2H2O
B. 提高吸收器中的反应温度可以提高反应速率,也提高反应物的利用率
C. 流程中的结晶、过滤操作应该是蒸发结晶、趁热过滤
D. 发生器中反应结束后,向其中通入一定量空气的目的是驱赶出ClO2,使其被充分吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿(主要成分CuFeS2)是提取Cu的主要原料。
已知:2CuFeS2+4O2![]() Cu2S+3SO2+2FeO(Ⅰ)
Cu2S+3SO2+2FeO(Ⅰ)
产物Cu2S在1200 ℃高温下继续反应:2Cu2S+3O2==2Cu2O+2SO2 (Ⅱ)
2Cu2O+Cu2S==6Cu +SO2↑ (Ⅲ)
假定各步反应都完全。则下列说法正确的是
A. 反应Ⅰ中CuFeS2仅作还原剂
B. 取12.5g黄铜矿样品,经测定含3.60g硫,则矿样中CuFeS2质量分数一定为82.8%
C. 由6molCuFeS2生成6molCu消耗O2的物质的量为14.25mol
D. 6molCuFeS2和15.75molO2反应,理论上可得到铜的物质的量为3mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z为短周期元素,X的最外层电子数是Y原子最外层电子数的2倍,Y的原子序数比X的原子序数多5,Z原子的最外层电子数比Y多3。下列叙述正确的是( )
A.原子半径的大小顺序:Y>Z>X
B.Z单质与X单质直接反应可生成两种化合物
C.工业上,电解X和Y形成的化合物制取Y单质
D.Y、Z元素的最高价氧化物的水化物不能互相反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com