
����Ŀ�����������£�����������5L�ܱ������У�����2molCO��3molH2������Ӧ��CO(g)+2H2(g)![]() CH3OH(g)��ƽ���CH3OH�����ʵ���Ϊ1mol������������ȷ����
CH3OH(g)��ƽ���CH3OH�����ʵ���Ϊ1mol������������ȷ����
A. �淴Ӧ�Ľ��У������ƽ����Է���������С
B. H2��ƽ��ת����Ϊ50%
C. ���¶ȷ�Ӧ��ƽ�ⳣ��K��25L2��mol��2
D. ƽ�������������ͨ��3mol CO��ƽ�ⲻ�ƶ�
���𰸡�C
��������
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
��ʼ��(mol) 2 3 0
ת����(mol) 1 2 1
ƽ����(mol) 1 1 1
A����ΪM=m/n���淴Ӧ�Ľ��У������������������䣬�����ܵ����ʵ�����С���ʻ�������ƽ����Է�������������A����
B��������ƽ��ת����Ϊ2/3��100%��66.7%����B����
C�����¶ȷ�Ӧ��ƽ�ⳣ��K=![]() ��25����C��ȷ��
��25����C��ȷ��
D��ƽ�������������ͨ��3molCO����Ӧ��Ũ������ƽ�������ƶ�����D����
��ѡC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���У���ȷ����
A. ʹ�ô�����Ϊ�˼ӿ췴Ӧ���ʣ����ԭ�ϵ�������
B. ȼ��һ�����Ƿ��ȷ�Ӧ
C. ȼ�ձ���Ҫ���������뷴Ӧ
D. ���ˮ��������������ȼ���ǿ��淴Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H2O2�ֽ������ܶ�������Ӱ�졣ʵ����70 ��ʱ��ͬ������H2O2Ũ����ʱ��ı仯��ͼ��ʾ������˵����ȷ����
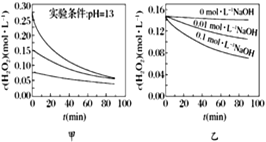
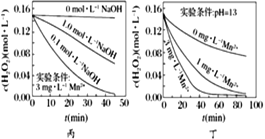
A. ͼ�ױ���������������ͬʱ��H2O2Ũ��ԽС����ֽ�����Խ��
B. ͼ�ұ���������������ͬʱ����Һ����Խ����H2O2�ֽ�����Խ��
C. ͼ������������Mn2������ʱ����Һ����Խǿ��H2O2�ֽ�����Խ��
D. ͼ��������������Һ�У�Mn2����H2O2�ֽ����ʵ�Ӱ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Դ�����þ��й���ǰ����
��1����ͼ�ǴӺ�ˮ����ȡþ�ļ����̡�
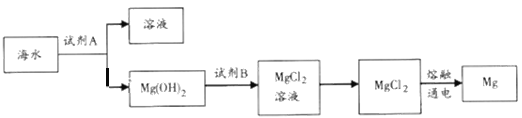
�ٹ�ҵ�ϳ����ڳ���Mg2+���Լ�A��__________���ѧʽ����Mg(OH)2ת��ΪMgCl2�����ӷ���ʽΪ________________________��
������ˮMgCl2��ȡMg�Ļ�ѧ����ʽ��______________________��
��2���������и�����I����ʽ���ڵĵ�Ԫ�أ�ʵ������ȡI2��;��������ʾ��
![]()
�����պ������ҽ�ʱ���õ���Ҫ������__________�������ƣ���
�����ữ����Һ�мӹ���������Һ���÷�Ӧ�����ӷ���ʽΪ__________��
�۷�Ӧ��������CCl4����ȡ��,������ȡ����Һ�ķ����ӵ�ˮ����ȡ�⣬��Ҫ������������ͼ��
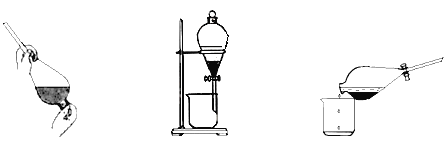
��.������ȡ������ ��.���÷ֲ� ��.����
�ס��ҡ���3��ʵ������У��������__________������������������������������
��3����ˮ�в������ӵĺ�������:
�ɷ� | ������mg/L�� | �ɷ� | ������mg/L�� |
Na+ | 10560 | Cl�� | 18980 |
Mg2+ | 1272 | Br�� | 64 |
Ca2+ | 400 | SO42�� | 2560 |
����100L�ú�ˮ����ȡþ��������������Լ�A__________g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ɳ���þ������ر�﮵�ؾ��и��ߵ������ܶȺͰ�ȫ�ԣ��ڳ��ͷŵ�ʱ�����ط�ӦΪMg+2MnF3![]() 2MnF2+MgF2������˵������ȷ������ ��
2MnF2+MgF2������˵������ȷ������ ��
A. �ŵ�ʱ��þΪ��������
B. �ŵ�ʱ�����Ӵ�þ�����������������������
C. ���ʱ�������ĵ缫��ӦʽΪ��MnF2+F--e-=MnF3
D. ���ʱ�����ֱ����Դ����Ӧ��ԭ��ص�Mg������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У����÷�Һ©�����з������
A. �Ҵ���ˮ B. ���ͺ�ú��
C. ֲ���ͺ�ˮ D. ������Ȼ�̼
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ToC�£������Ϊ2 L�ĺ����ܱ�������ͨ��NO2��O2��������Ӧ��4NO2(g)+O2(g)![]() 2N2O5(g)��H��0������ʵ���������±�������˵������ȷ����
2N2O5(g)��H��0������ʵ���������±�������˵������ȷ����
ʱ��/s | 0 | 5 | 10 | 15 |
n(NO2)/mol | 8.00 | n1 | n2 | 4.00 |
n(O2)/mol | 2.00 | 1.25 | 1.00 | n3 |
A. 5s��NO2��ƽ����Ӧ����Ϊ0.3 mol/(Ls��
B. ��10 sʱ�����������г���2 mol N2O5(g)������ƽ���£�NO2���������������
C. ��5 s ʱ�����ھ��Ⱥ����´�ƽ�⣬��ƽ���µ�ƽ�ⳣ����ԭƽ���С
D. ToC���÷�Ӧ��ƽ�ⳣ��Ϊ0.125����Ӧ���ƽ��ת���ʾ�Ϊ50%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����25 �桢101 kPa�£�1 g�״�ȼ������CO2��Һ̬ˮʱ����22��68 kJ,�����Ȼ�ѧ����ʽ��ȷ����
A. CH3OH��l����3/2O2(g) ![]() CO2(g)+2H2O(l) ����H=+725��8 kJ��mol��1
CO2(g)+2H2O(l) ����H=+725��8 kJ��mol��1
B. 2CH3OH��l��+3O2(g) ![]() 2CO2(g)+4H2O(l) ����H=��1 452 kJ��mol��1
2CO2(g)+4H2O(l) ����H=��1 452 kJ��mol��1
C. 2CH3OH(l)+3O2(g) ![]() 2CO2(g)+4H2O(l) ����H=��725��8 kJ��mol��1
2CO2(g)+4H2O(l) ����H=��725��8 kJ��mol��1
D. 2CH3OH��l��+3O2(g) ![]() 2CO2(g)+4H2O(l) �� ��H=+1 452 kJ��mol��1
2CO2(g)+4H2O(l) �� ��H=+1 452 kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO(g)��H2O(g)��Ӧ�������仯��ͼ��ʾ���й����߷�Ӧ��˵����ȷ����(����)

A. �÷�ӦΪ���ȷ�Ӧ
B. �÷�Ӧ����Ҫ���Ⱦ��ܽ���
C. 1 molCO(g)��1mol H2O(g)�������������1 molCO2(g)��1 molH2(g)���������
D. 1 molCO2(g)��1 molH2(g)��Ӧ����1 molCO(g)��1mol H2O(g)Ҫ�ų�41 kJ����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com