
【题目】某兴趣小组的同学用如图所示装置研究有关电化学的问题。当闭合该装置的电键时,观察到检流计的指针发生了偏转。
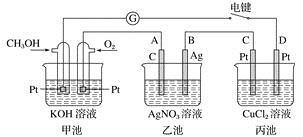
请回答下列问题:
![]() 甲池为________
甲池为________![]() 填“原电池”“电解池”或“电镀池”
填“原电池”“电解池”或“电镀池”![]() ,通入
,通入![]() 电极的电极反应式为__________。
电极的电极反应式为__________。
![]() 乙池中
乙池中![]() 石墨
石墨![]() 电极的名称为________
电极的名称为________![]() 填“正极”“负极”“阴极”或“阳极”
填“正极”“负极”“阴极”或“阳极”![]() ,总反应式为_______。
,总反应式为_______。
![]() 当乙池中B极质量增加
当乙池中B极质量增加![]() 时,甲池中理论上消耗
时,甲池中理论上消耗![]() 的体积为________
的体积为________![]() 标准状况下
标准状况下![]() ,丙池中________极析出________g铜。电键闭合一段时间后,甲中溶液的pH将________
,丙池中________极析出________g铜。电键闭合一段时间后,甲中溶液的pH将________![]() 填“增大”“减小”或“不变”
填“增大”“减小”或“不变”![]() 。
。
【答案】原电池 ![]() 阳极
阳极 ![]()
![]()
![]()
![]() D
D ![]() 减小
减小
【解析】
根据图示装置特点判断装置为原电池,根据燃料电池原理书写电极反应式;根据电极反应式及电子转移守恒进行相关计算,并判断pH的变化。
![]() 甲池为原电池,燃料在负极失电子发生氧化还原反应在碱溶液中生成碳酸盐,甲池中通入
甲池为原电池,燃料在负极失电子发生氧化还原反应在碱溶液中生成碳酸盐,甲池中通入![]() 电极的电极反应为:
电极的电极反应为:![]() ;
;
![]() 乙池是电解池,A与原电池正极相连,为阳极,电池反应为:
乙池是电解池,A与原电池正极相连,为阳极,电池反应为:![]()
![]()
![]() ;
;
![]() 当乙池中B极质量增加
当乙池中B极质量增加![]() 为Ag,物质的量
为Ag,物质的量![]()
![]() ,依据电子守恒计算
,依据电子守恒计算![]() ,甲池中理论上消耗
,甲池中理论上消耗![]() 的体积
的体积![]() ;丙为电解池,C为阳极,D为阴极,电解氯化铜溶液铜离子在阴极得到电子析出铜,结合电子守恒计算
;丙为电解池,C为阳极,D为阴极,电解氯化铜溶液铜离子在阴极得到电子析出铜,结合电子守恒计算![]() ,析出铜质量
,析出铜质量![]()
![]() ;甲中甲醇与氧气、氢氧化钾反应生成碳酸钾和水,反应消耗氢氧根离子,则pH减小,故答案为:280;D;
;甲中甲醇与氧气、氢氧化钾反应生成碳酸钾和水,反应消耗氢氧根离子,则pH减小,故答案为:280;D;![]() ;减小。
;减小。


科目:高中化学 来源: 题型:
【题目】硫酸锰是一种重要的化工中间体,是锰行业研究的热点。一种以高硫锰矿(主要成分为含锰化合物及FeS)为原料制备硫酸锰的工艺流程如下:

已知:①“混合焙烧”后烧渣含MnSO4、Fe2O3及少量FeO、Al2O3、MgO。
②金属离子在水溶液中的平衡浓度与pH的关系如图所示(25℃):

③此实验条件下Mn2+开始沉淀的pH为7.54;离子浓度≤10-5mol·L-1时,离子沉淀完全。
请回答:
(1)传统工艺处理高硫锰矿时,不经“混合焙烧”,而是直接用H2SO4浸出,其缺点为___________。
(2)“氧化”时,发生反应的离子方程式为_________________________________。若省略“氧化”步骤,造成的后果是_________________________________。
(3)“中和除杂”时,生成沉淀的主要成分为______________________(填化学式)。
(4)“氟化除杂”时,若使溶液中的Mg2+和Ca2+沉淀完全,需维持c(F-)不低于___________。(已知:Ksp(MgF2)=6.4×10-10;Ksp(CaF2)=3.6×10-12)
(5)“碳化结晶”时,发生反应的离子方程式为______________________。
(6)“系列操作”指___________、过滤、洗涤、干燥
(7)用惰性电极电解MnSO4溶液可制备MnO2,电解过程中阳极的电极反应式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH<0,降低温度产生的影响为( )
2SO3(g) ΔH<0,降低温度产生的影响为( )
A.v正 增大,v逆减小B.v正减小,v逆增大
C.v正和v逆同程度的增大D.v正和v逆不同等程度的减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题:

(1)指出图中两处明显的错误:①_________________;②_________________。
(2)B仪器的名称是______,
(3)A中除加入少量自来水外,还需加入少量沸石,其作用________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用软锰矿浆烟气脱硫吸收液制取电解锰,并利用阳极液制备高纯碳酸锰、回收硫酸铵的工艺流程如下(软锰矿的主要成分是MnO2,还含有硅、铁、铝的氧化物和少量重金属化合物等杂质):

(1)一定温度下,“脱硫浸锰”主要产物为MnSO4,该反应的化学方程式为______________________。
(2)“滤渣2”中主要成分的化学式为______________________。
(3)“除重金属”时使用(NH4)2S而不使用Na2S的原因是_______________________________________。
(4)“电解”时用惰性电极,阳极的电极反应式为____________________________。
(5)“50℃碳化”得到高纯碳酸锰,反应的离子方程式为_______________________________________。“50℃碳化”时加入过量NH4HCO3,可能的原因是______________________________________(写两种)。
(6)已知:25℃时,KW=1.0×10-14,Kb(NH3·H2O)=1.75×10-5。在(NH4)2SO4溶液中,存在如下平衡:
NH4++H2O![]() NH3·H2O+H+,则该反应的平衡常数为____________________。
NH3·H2O+H+,则该反应的平衡常数为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组热化学方程式中,化学反应的ΔH前者大于后者的是( )
①C(s)+O2(g)= CO2(g)ΔH1;C(s)+ ![]() O2(g)= CO(g)ΔH2
O2(g)= CO(g)ΔH2
②S(s)+O2(g)= SO2(g)ΔH3;S(g)+O2(g)=SO2(g)ΔH4
③H2(g)+ ![]() O2(g)=H2O(l)ΔH5;2H2(g)+O2(g)= 2H2O(l)ΔH6
O2(g)=H2O(l)ΔH5;2H2(g)+O2(g)= 2H2O(l)ΔH6
④CaCO3(s)= CaO(s)+CO2(g)ΔH7;CaO(s)+H2O(l)= Ca(OH)2(s)ΔH8
A.①B.④C.②③④D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】消除氮氧化物、二氧化硫等物质造成的污染是目前研究的重要课题。
(1)工业上常用活性炭还原一氧化氮,其反应为:2NO(g)+C(s)![]() N2(g)+CO2(g)。向容积均为lL的甲、乙、丙三个恒容恒温容器中分别加入足量的活性炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g)。向容积均为lL的甲、乙、丙三个恒容恒温容器中分别加入足量的活性炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
t/min n(NO)/mol T | 0 | 40 | 80 | 120 | 160 | |
甲 | T℃ | 2 | 1.45 | 1 | 1 | 1 |
乙 | 400℃ | 2 | 1.5 | 1.1 | 0.8 | 0.8 |
丙 | 400℃ | 1 | 0.8 | 0.65 | 0.53 | 0.45 |
①甲容器反应温度T℃__400℃(填“>”或“<”或“=”);
②乙容器中,0~40min内平均反应速率v(N2)=__;
③丙容器中达平衡后NO的转化率为__。
(2)活性炭还原NO2的反应为:2NO2(g)+2C(s)![]() N2(g)+2CO2(g),在恒温条件下,lmolNO2和足量活性炭发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,lmolNO2和足量活性炭发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:

①A、B、C三点中NO2的转化率最高的是__点(填“A”或“B”或“C”)。
②计算C点时该反应的压强平衡常数KP=__MPa(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)燃煤烟气脱硫常用如下方法。
方法①:用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫。涉及的部分反应如下:
2CO(g)+SO2(g)=S(g)+2CO2(g) △H1=8.0kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H2=-566.0kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H3=-483.6kJ·mol-1
则H2(g)还原SO2(g)生成S(g)和H2O(g)的热化学方程式为__。
方法②:用氨水将SO2转化为NH4HSO3,再氧化成(NH4)2SO4,则用氨水将SO2转化为NH4HSO3的离子方程式为__;实验测得NH4HSO3溶液中![]() =15,则溶液的pH为__。(已知:H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)
=15,则溶液的pH为__。(已知:H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组用如图所示的实验装置探究氯气与氨气之间的反应。其中 A、F 为氨气和氯气的发生装置,C 为纯净、干燥的氯气与氨气反应的装置。
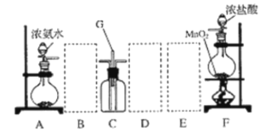
请回答下列问题:
(1)装置 F 中发生反应的离子方程式是______________。
(2)装置 A 中的烧瓶内固体可选用_______________(选填以下选项的代号)。
A 碱石灰 B 浓硫酸 C 生石灰 D 五氧化二磷 E 烧碱
(3)虚线框内应添加必要的除杂装置,请从图的备选装置中选择,并将编号填入下列空格:
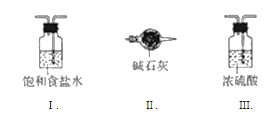
B___D____E_____
(4)氯气和氨气在常温下混合就能发生反应生成氯化铵和氮气,该反应的化学方程式为: ________;装置 C 内出现浓厚的白烟,该物质化学式为_________。
(5)若从装置 C 中 G 处逸出的尾气中含有 N2 和少量 C12,应如何处理________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律,下列叙述不正确的是( )

A.气态氢化物的稳定性:H2O>NH3>SiH4
B.如图所示实验可证明元素的非金属性:Cl>C>Si
C.用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
D.元素周期表中第14列非金属元素对应的气态氢化物沸点从上到下逐渐升高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com