
【题目】为了探究三种气体(SO2、NO2、Cl2)的性质,某同学设计了两组实验:
(1)实验一:用三个集气瓶收集满二氧化硫、二氧化氮气体,然后将其倒置在水槽中。分别缓慢通入适量O2或Cl2,如图1所示。一段时间后,D、E装置的集气瓶中充满溶液,F装置的集气瓶中还有气体剩余。
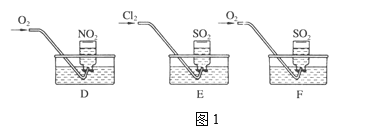
(假设瓶内液体不扩散):
①写出装置E中反应的离子方程式:____________________.
②假设该实验条件为标准状况,则装置D的集气瓶中所得溶液溶质的物质的量浓度为____________.
③通入氧气前在F装置的水槽里滴加几滴紫色石蕊溶液,观察到的现象是F装置集气瓶内溶液显浅红色,通入氧气后,可能观察到的实验现象是 _____________________________,写出反应的总化学方程式:________________.
(2)实验二:分别利用下图所示装置探究氯气的氧化性。
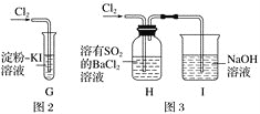
①G中的现象是_______________,原因是 ________________________(用化学方程式表示)。
②H中的现象是_________________________.
【答案】Cl2+SO2+2H2O=4H++2Cl-+SO42- 0.045mol·L-1 溶液红色加深 2SO2+O2+2H2O=2H2SO4 溶液由无色变为蓝色 Cl2+2KI=I2+2KCl 产生白色沉淀
【解析】
(1)根据氯气具有强氧化性,二氧化硫有还原性,两者发生氧化还原反应进行解答;(2)根据4NO2+O2+2H2O=4HNO3的反应特点,反应后液体能充满整个集气瓶,再根据浓度计算公式进行解答;(3)根据氯气具有强氧化性,能氧化I-和SO2气体进行分析。
(1)①E中二氧化硫和氯气反应生成硫酸和盐酸,其反应的离子方程式为:Cl2+SO2+2H2O=4H++2Cl-+SO42;
②D中二氧化氮、水、氧气反应生成硝酸,反应为4NO2+O2+2H2O=4HNO3,水会充满集气瓶,设集气瓶体积为VL,最后溶液的体积为VL,由4NO2+O2+2H2O=4HNO3 n(NO2)=n(HNO3),则所得溶液溶质的物质的量浓度为c=![]() =
=![]() L/mol=0.045mol·L-1;
L/mol=0.045mol·L-1;
(3)F装置中二氧化硫与水反应生成的亚硫酸溶液显酸性,滴加几滴紫色石蕊试液,观察到
的现象是紫色溶液变红,再通入氧气,发生2SO2+O+2H2O=2H2SO4,酸性增强,红色由浅变深;
(2)①G中是淀粉碘化钾溶液中通入Cl2,发生反应的化学方程式为:Cl2+2KI=I2+2KCl,生成的I2遇到淀粉变蓝;
②H中装有溶有二氧化硫的BaCl2的溶液,通入氯气后,二氧化硫被氧化为硫酸,遇到BaCl2的溶液会生成硫酸钡的白色沉淀。


 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
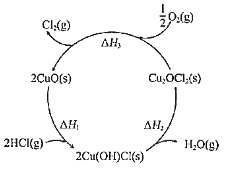
【题目】近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长。因此,将氯化氢转化为氯气的技术成为科学研究的热点。请回答:
(1)如图表示在CuO存在下HCl催化氧化的反应过程,则总反应的化学方程为______。
(2)研究HCl催化氧化反应中温度、![]() 和
和![]() 等因素对HCl转化率的影响,得到如下实验结果:
等因素对HCl转化率的影响,得到如下实验结果:
①利用Na2S2O3溶液和KI溶液测定反应生成Cl2的物质的量,若消耗V1mLc1mol·L-1的Na2S2O3溶液,则生成Cl2____________mol(已知2S2O![]() +I2=S4O
+I2=S4O![]() +2I-)。
+2I-)。
②![]() 表示催化剂的质量与HCl(g)流速之比,是衡量反应气体与催化剂接触情况的物理量。当
表示催化剂的质量与HCl(g)流速之比,是衡量反应气体与催化剂接触情况的物理量。当![]() =4、
=4、![]() =50g·min·mol-1时,每分钟流经1g催化剂的气体体积为_____L(折算为标准状况下)。
=50g·min·mol-1时,每分钟流经1g催化剂的气体体积为_____L(折算为标准状况下)。
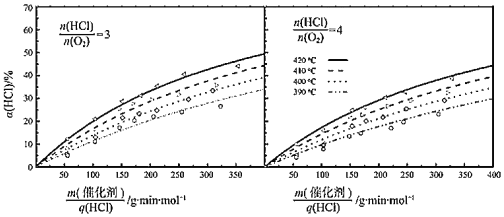
③在420℃、![]() =3、
=3、![]() =200g·min·mol-1条件下,α(HCl)为33.3%,则O2的反应速率为_______mol·g-1·min-1。
=200g·min·mol-1条件下,α(HCl)为33.3%,则O2的反应速率为_______mol·g-1·min-1。
④比较在下列两种反应条件下O2的反应速率:vⅠ_______vⅡ(填“>”“=”或“<”)。
Ⅰ.410℃、![]() =3、
=3、![]() =350g·min·mol-1;
=350g·min·mol-1;
Ⅱ.390℃、![]() =4、
=4、![]() =350g·min·mol-1。
=350g·min·mol-1。
(3)在101.325kPa时,以含N2的HCl和O2的混合气体测定不同温度下HCl催化氧化反应中HCl的平衡转化率,得到如图结果
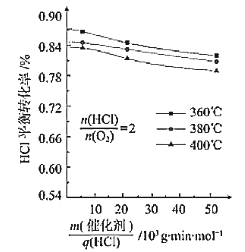
①360℃时反应的平衡常数K360与400℃时反应的平衡常数K400之间的关系是K360_________K400。(填“>”“=”或“<”)。
②一定温度下随着![]() 的增大,HCl的平衡转化率_______(填“增大”“减小”或“不变”),原因为___________________。
的增大,HCl的平衡转化率_______(填“增大”“减小”或“不变”),原因为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,定容密闭容器中0.4mol/LN2,1mol/LH2进行反应:N2(g)+ 3H2(g)![]() 2NH3(g),10min反应达到平衡,此时测得N2浓度为0.2mol/L。
2NH3(g),10min反应达到平衡,此时测得N2浓度为0.2mol/L。
(1)10min内,用H2浓度变化来表示的反应速率为___,平衡时NH3的物质的量浓度为____;
(2)能判断该反应达到化学平衡状态的依据是____
A.容器中密度不随时间变化而变化 B.容器中各物质的浓度保持不变
C.N2和NH3的消耗速率之比为2∶1 D.N2消耗速率与H2生成速率之比为3:1
(3)平衡时N2和H2的转化率之比为____;该反应的平衡常数表达式为K=____,该温度下反应的平衡常数是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用废旧镀锌铁皮可制备磁性Fe3O4胶体粒子及副产物ZnO,制备流程如下图所示
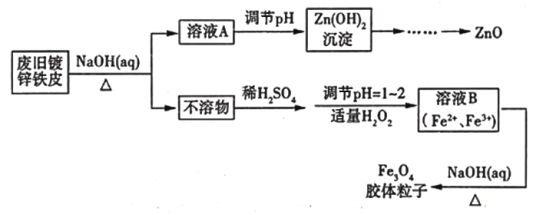
(1)从流程图可知,Zn、Fe中能与NaOH溶液反应的是_______________________。
(2)向不溶物中加入稀硫酸发生反应的离子方程式是____________________________________。
(3)加入适量H2O2的目的是__________________________________。
(4)如何证明已生成了Fe3O4胶体?_____________________________________________________。
(5)流程中所需的硫酸溶液由焦硫酸(H2SO4·SO3)溶于水配制而成,其中的SO3都转化为硫酸,若将445g焦硫酸溶于水配成4.00L硫酸,该硫酸的物质的量浓度为__________________mol/L。
(6)稀硫酸也可以用浓硫酸和水配制。已知4 mol/L的硫酸溶液密度为ρ1g/cm3,2 mol/L的硫酸溶液密度为ρ2g/cm3。100g物质的量浓度为4 mol/L的硫酸溶液与___________mL水混合,使硫酸的物质的量浓度减小到2 mol/L(用含ρ1、ρ2的式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() ,25℃时,
,25℃时,![]() 的
的![]() 。该温度下用
。该温度下用![]() 溶液滴定
溶液滴定![]() 溶液的滴定曲线如图所示。下列说法不正确的是( )
溶液的滴定曲线如图所示。下列说法不正确的是( )
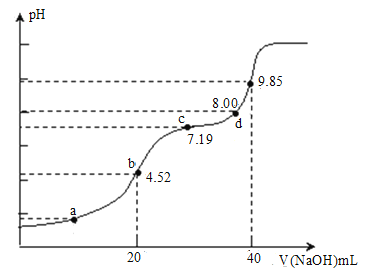
A.若a点溶液c(![]() )=c(H2SO3),则a点对应的
)=c(H2SO3),则a点对应的![]()
B.若选择b为反应终点,宜选择甲基橙为指示剂
C.c点对应的溶液2c(Na+)=3c(![]() )
)
D.d点对应的溶液c(Na+)>c(![]() )>c(
)>c(![]() )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是以空气、海水中的物质为原料制取纯碱的工业流程:
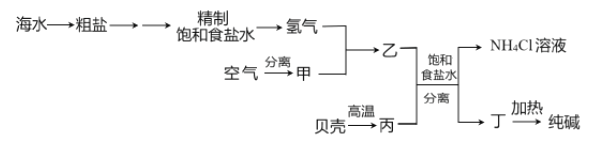
已知粗盐中含有Ca2+、Mg2+、SO42-等杂质离子。下列有关说法不正确的是
A. 除去粗盐中的杂质离子可依次加入NaOH溶液、BaCl2溶液、Na2CO3溶液
B. 甲、丙分别为N2、CO2
C. 分离得到丁和NH4Cl溶液的操作是过滤
D. 上述流程中物质转化有涉及置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中发生如下反应:2X(g)+Y(g) ![]() 2Z(g) △H<0,下图是表示该反应速率(v)随时间(t)变化的关系图。t1、t2、t5时刻外界条件均有改变(但都没有改变各物质的用量)。则下列说法中正确的是( )
2Z(g) △H<0,下图是表示该反应速率(v)随时间(t)变化的关系图。t1、t2、t5时刻外界条件均有改变(但都没有改变各物质的用量)。则下列说法中正确的是( )

A. t3时降低了温度 B. t5时增大了压强
C. t6时刻后反应物的转化率最低 D. t4时该反应的平衡常数小于t6时反应的平衡常数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】被誉为中国“新四大发明”的复方蒿甲醚是第一个由中国发现的全新化学结构的药品,也是目前在国际上获得广泛认可的中国原创药品。至今已被多个亚非国家指定为疟疾治疗一线用药,它在疟疾这一高传染性疾病治疗史上具有里程碑意义。其主要成分是青蒿素(是一种由青蒿中分离得到的具有新型化学结构的抗疟药),结构如图所示。有关该化合物的叙述正确的是( )
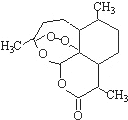
A.分子式为:C16H22O5
B.该化合物在一定条件下不能与NaOH溶液反应
C.该化合物中含有过氧键,一定条件下有氧化性
D.青蒿素与维生素一样是水溶性的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,根据I2析出所需时间可以求得NaHSO3的反应速率。将浓度均为0.020mol·L-1NaHSO3(含少量淀粉)10.0mL、KIO3(过量)酸性溶液40.0mL混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图。据图分析,下列判断不正确的是

A. 40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反
B. 图中b、c两点对应的NaHSO3反应速率相等
C. 图中a点对应的NaHSO3反应速率为5.0 ×10-5mol·L-1·s-1
D. 温度高于40℃时,淀粉不宜用作该实验的指示剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com