
【题目】被誉为中国“新四大发明”的复方蒿甲醚是第一个由中国发现的全新化学结构的药品,也是目前在国际上获得广泛认可的中国原创药品。至今已被多个亚非国家指定为疟疾治疗一线用药,它在疟疾这一高传染性疾病治疗史上具有里程碑意义。其主要成分是青蒿素(是一种由青蒿中分离得到的具有新型化学结构的抗疟药),结构如图所示。有关该化合物的叙述正确的是( )
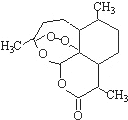
A.分子式为:C16H22O5
B.该化合物在一定条件下不能与NaOH溶液反应
C.该化合物中含有过氧键,一定条件下有氧化性
D.青蒿素与维生素一样是水溶性的
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.核外电子的排布应优先排布在能量最低的电子层
B.对于主族元素而言,若最外层电子数为m,电子层数为n,则![]() 值越大,金属性越强
值越大,金属性越强
C.同一周期中,随着核电荷数的增加,阴离子半径逐渐增大
D.第三、四周期中,同族元素原子的核电荷数相差一定为8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究三种气体(SO2、NO2、Cl2)的性质,某同学设计了两组实验:
(1)实验一:用三个集气瓶收集满二氧化硫、二氧化氮气体,然后将其倒置在水槽中。分别缓慢通入适量O2或Cl2,如图1所示。一段时间后,D、E装置的集气瓶中充满溶液,F装置的集气瓶中还有气体剩余。
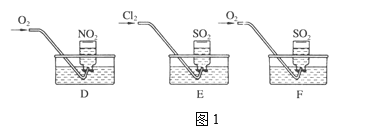
(假设瓶内液体不扩散):
①写出装置E中反应的离子方程式:____________________.
②假设该实验条件为标准状况,则装置D的集气瓶中所得溶液溶质的物质的量浓度为____________.
③通入氧气前在F装置的水槽里滴加几滴紫色石蕊溶液,观察到的现象是F装置集气瓶内溶液显浅红色,通入氧气后,可能观察到的实验现象是 _____________________________,写出反应的总化学方程式:________________.
(2)实验二:分别利用下图所示装置探究氯气的氧化性。
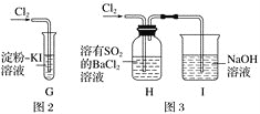
①G中的现象是_______________,原因是 ________________________(用化学方程式表示)。
②H中的现象是_________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恩杂鲁胺(9)是一种是重要药物,以下是合成恩杂鲁胺的一种方法:
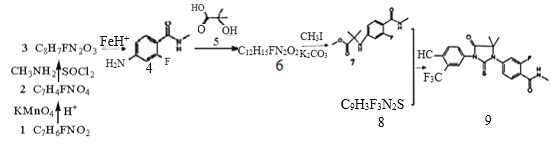
已知:①![]()
②![]()
请回答:
(1)下列说法不正确的是____________。
A.1→4的反应类型,分别是:氧化反应、取代反应、还原反应
B.恩杂鲁胺的分子式为:![]()
C.7和8反应,除生成9外还有![]() 生成
生成
D.4既能与盐酸反应,也能与![]() 溶液反应,是一种两性物质
溶液反应,是一种两性物质
(2)写出化合物8的结构简式_____________。
(3)写出![]() 的化学方程式__________。
的化学方程式__________。
(4)设计以2-甲基丙烯为原料,制备物质5的合成路线(用流程图表示,无机试剂任选)__________。
(5)写出化合物4同时符合下列条件的同分异构体的结构简式______________。
①是苯的对二取代物,能使氯化铁溶液显紫色;
②![]() 谱和
谱和![]() 谱检测表明:分子中共有5种氢原子,有
谱检测表明:分子中共有5种氢原子,有![]() 键;
键;
③除了苯环外还有一个三元环且氮原子不与苯环直接相连。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组需配制含有NH4+、Cl-、K+、SO42-的植物培养液450mL,且要求该培养液中c(Cl-)=c(K+)=c(SO42-)=0.4mol·L1。实验室提供的药品有:NH4Cl、KCl、(NH4)2SO4、K2SO4和蒸馏水;提供的实验仪器有:①药匙②托盘天平③烧杯④胶头滴管⑤量筒。请回答下列问题:
(1)该植物培养液中,NH4+的物质的量浓度为____。
(2)该研究小组配制该植物培养液时,还须用到的玻璃仪器是____、_____。
(3)若配制该培养液的其他操作均正确,则下列错误操作将使所配制溶液的浓度偏低的是____。
a.将溶液转移至容量瓶后,未洗涤烧杯和玻璃棒
b.将烧杯内的溶液向容量瓶中转移时,容量瓶中还有少量的水
c.将烧杯内的溶液向容量瓶中转移时,因操作不当使部分溶液溅出容量瓶
d.用胶头滴管向容量瓶中加水时,俯视容量瓶刻度线
e.摇匀后发现液面低于容量瓶刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下一种烷烃A和一种单烯烃B组成混合气体,A或B分子最多只含有4个碳原子,且B分子的碳原子数比A分子的多。
(1)将该混合气体1L充分燃烧在同温、同压下得2.5LCO2,试推断原混合气体A中和B所有可能的组合及其体积比___。
(2)120℃时取1L该混合气体与9L氧气混合,充分燃烧后,当恢复到120℃和燃烧前的压强时,体积增大6.25%,试通过计算确定混合气中各成分的分子式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据如图判断,下列说法正确的是( )
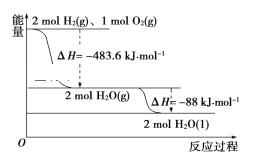
A. 氢气的燃烧热ΔH=-241.8 kJ·mol-1
B. 2 mol H2(g)与1mol O2(g)所具有的总能量比2 mol H2O(g)所具有的总能量低
C. 液态水分解的热化学方程式为2H2O(l)=2H2(g)+O2(g) ΔH=+571.6 kJ·mol-1
D. H2O(g)生成H2O(l)时,断键吸收的能量小于成键放出的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述正确的是( )
A. 已知2H2(g)+O2(g) =2 H2O(g) △H=-483.6kJ·mol-1,则氢气的燃烧热△H=-241.8 kJ/mol
B. 已知2C(s)+2O2(g)=2CO2(g)△H1;2C(s)+O2(g)=2CO(g)△H2,则△H1>△H2
C. 含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为: NaOH(aq)+CH3COOH(aq) = CH3COONa(aq) + H2O(l) △H =-57.4kJ·mol-1
D. CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)=2CO(g)+O2(g) △H=+566.0 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能证明碳酸的酸性比硅酸强的事实是
A. 二氧化碳溶于水且能反应生成碳酸,二氧化硅不溶于水不能与水反应生成硅酸
B. 在高温下,二氧化硅与碳酸钠能发生反应:SiO2+Na2CO3![]() Na2SiO3+CO2↑
Na2SiO3+CO2↑
C. 二氧化硅的熔点比二氧化碳的熔点高
D. 二氧化碳通入硅酸钠溶液中,生成白色胶状沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com