
【题目】(1)甲烷制氢是一种廉价的制氢方法。有关的热化学方程式如下:
![]() ;
;![]() ①
①
![]() ;
;![]() ②
②
①下列说法正确的是 ______。
A.![]()
B.当反应①中![]() 时,表明该反应达平衡状态
时,表明该反应达平衡状态
C.其它条件不变时,增大体系压强,反应①②中甲烷的转化率均增大
D.为维持恒定温度![]() 不考虑热量损失
不考虑热量损失![]() ,某反应器中同时发生反应①与②时,消耗甲烷的物质的量之比为6:1
,某反应器中同时发生反应①与②时,消耗甲烷的物质的量之比为6:1
②某温度下,在100L反应器中充入甲烷和水蒸汽的物质的量分别为100mol和300mol时,假定只发生反应![]() 当甲烷的转化率为
当甲烷的转化率为![]() 时,此时平衡常数为 ______。
时,此时平衡常数为 ______。
(2)蓝液是由![]() 、
、![]() 及NaOH配成的,在加热条件下,通过三步反应使铁表面生成一层致密的
及NaOH配成的,在加热条件下,通过三步反应使铁表面生成一层致密的![]() :
:
![]()
![]()
![]() ①
①
![]()
![]()
![]() ②
②
以及第三步生成四氧化三铁,请补充第三步反应的方程式并配平: ______。
①为了使铝表面形成较厚的氧化膜,工业上常用电解硫酸溶液的方法,在阳极上生成氧化铝,写出此时阳极的电极反应: ______。
②将固体草酸锰![]() 放在一个可以称出质量的容器里加热,固体质量随温度的变化关系如图所示
放在一个可以称出质量的容器里加热,固体质量随温度的变化关系如图所示![]() 质量单位为
质量单位为![]() :则
:则![]() 时,剩余固体的成分为 ______(填化学式);在
时,剩余固体的成分为 ______(填化学式);在![]() ,剩余固体的成分为 ______(填化学式)。
,剩余固体的成分为 ______(填化学式)。
【答案】D ![]()
![]()
![]()
![]() MnO
MnO
【解析】
(1)①已知:
![]() ;
;![]() ①
①
![]() ;
;![]() ②
②
A.由反应②-①可计算H2O(g)=H2(g)+![]() O2(g)的△H=+252kJmol-1,则2H2O(g)=2H2(g)+O2(g)△H=+504kJmol-1,气态水的能量比液态水能量高,故A错误;
O2(g)的△H=+252kJmol-1,则2H2O(g)=2H2(g)+O2(g)△H=+504kJmol-1,气态水的能量比液态水能量高,故A错误;
B.当反应①中υ(CH4)正=υ(CO)正时,依据速率之比等于化学方程式计量数之比,均是正反应速率之比,不能表明该反应达平衡状态,故B错误;
C.反应均为气体体积增大的反应,增大压强,平衡逆向移动,所以反应①②中甲烷的转化率均减小,故C错误;
D.维持恒定温度,吸收与放出的热量相等,则反应器中同时发生反应①与②时,消耗甲烷的物质的量之比为![]() =6:1,故D正确;
=6:1,故D正确;
故答案为D;
②结合题意,列“三段式”:
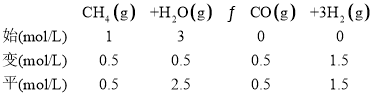
K=![]() =1.35;
=1.35;
(2)由①②及生成四氧化三铁可知,Na2FeO2、Na2Fe2O4发生反应,该反应为Na2FeO2+Na2Fe2O4+2H2O=Fe3O4↓+4NaOH;
①在阳极上生成Al失去电子生成氧化铝,阳极电极反应为3H2O+2Al-6e-=Al2O3+6H+;
②设生成MnC2O4的质量为x,
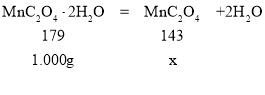
![]() ,解得x≈0.8g,则214℃时,结合图表,结晶水已全部失去,剩余固体的成分为MnC2O4;280℃时,由固体质量在减小,则草酸锰分解生成的锰的氧化物,可能是MnO或MnO2,根据锰元素守恒,
,解得x≈0.8g,则214℃时,结合图表,结晶水已全部失去,剩余固体的成分为MnC2O4;280℃时,由固体质量在减小,则草酸锰分解生成的锰的氧化物,可能是MnO或MnO2,根据锰元素守恒,
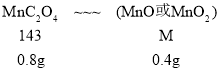
![]() ,解得M=71,则280℃时分解完全,剩余固体的成分为MnO。
,解得M=71,则280℃时分解完全,剩余固体的成分为MnO。


 培优口算题卡系列答案
培优口算题卡系列答案科目:高中化学 来源: 题型:
【题目】黄铁矿(主要成分FeS2)是工业制硫酸的主要原料,暴露在空气中会被缓慢氧化,其氧化过程如图所示。

(1)写出a步骤离子方程式________
(2)如何检验b步骤反应后的溶液中含Fe2+________
(3)取10mLb步骤反应后的溶液测定其成分,通入标准状况下Cl222.4mL恰好完全反应。然后调节pH,使溶液中的铁元素全部转化为沉淀,经过滤、洗涤、灼烧,冷却后称重,得固体质量为0.32g,则该溶液中c(Fe3+)=________(写出计算推理过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)AgNO3的水溶液呈___(填“酸”、“中”、“碱”)性,常温时的pH___7(填“>”、“=”、“<”),原因是(用离子方程式表示):___;实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以___(填“促进”、“抑制”)其水解。
(2)氯化铝水溶液呈___性,原因是(用离子方程式表示):___;把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是___。
(3)在配制氯化铝溶液时,为了防止发生水解,可以加入少量的___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积一定的密闭容器中![]() 和3mol
和3mol![]() 发生反应:
发生反应:![]()
![]()
![]() 。下列有关说法正确的是
。下列有关说法正确的是
A.降低温度可以加快反应速率
B.向容器中再加入![]() 可以加快反应速率
可以加快反应速率
C.达到化学反应限度时,生成2mol![]()
D.达到化学平衡时![]() 、
、![]() 、
、![]() 的物质的量之比为1:3:2
的物质的量之比为1:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1mol/L NaOH溶液滴定20mL 0.1mol/L CH3COOH溶液的滴定曲线如图。下列说法错误的是:

A.点①所示溶液中:c(CH3COO-)>c(CH3COOH)>c(Na+)>c(H+)>c(OH-)
B.点②所示溶液中:c(Na+)=c(CH3COO-)>c(H+)=c(OH-)
C.点①②③所示溶液中,均成立:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
D.点③表示整个滴定过程恰好达到滴定终点,在过程中溶液中![]() 始终不变
始终不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,若Ca(OH)2和CaWO4(钨酸钙)的沉淀溶解平衡曲线如图所示(已知![]() =0.58)。下列分析不正确的是
=0.58)。下列分析不正确的是
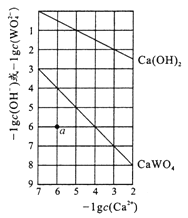
A. a点表示Ca(OH)2与CaWO4均未达到溶解平衡状态
B. 饱和Ca(OH)2溶液和饱和CaWO4溶液等体积混合: c(OH-)>c(H+)>c(Ca2+)>c(WO42-)
C. 饱和Ca(OH)2溶液中加入少量Na2O,溶液变浑浊
D. 石灰乳与0.1mol/LNa2WO4溶液混合后发生反应:Ca(OH)2+WO42-=CaWO4+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mL0.1mol·L-1CuCl2溶液中滴入0.1ml·L-1的Na2S溶液,滴加过程中溶液中-1gc(Cu2+)随滴人的Na2S溶液体积的变化如图所示。下列叙述正确的是
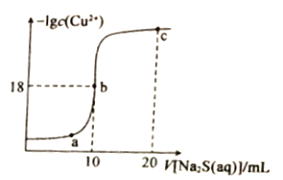
A. Na2S溶液中:c(S2-)+c(HS-)+c(H2S)==2c(Na+)
B. Ksp(CuS)的数量级为10-36
C. a、b、c三点溶液中,b点水的电离程度最大
D. c点溶液中:c(C1-)=2c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向10 mL 0.1 mol·L-1 CuCl2溶液中滴加0.1 mol·L-1的Na2S溶液,滴加过程中-lg c(Cu2+)与Na2S溶液体积的关系如图所示。下列有关说法正确的是
已知:Ksp(ZnS)=3×10-25
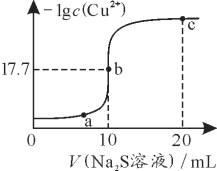
A. Na2S溶液中:c(S2-)+c(HS-)+c(H2S)=2c(Na+)
B. a、b、c三点对应的溶液中,水的电离程度最大的为b点
C. 该温度下,Ksp(CuS)=1×10-35.4
D. 向100 mL Zn2+、Cu2+物质的量浓度均为0.1mol·L-1的混合溶液中逐滴加入10-3 mol·L-1的Na2S溶液,Zn2+先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第三代混合动力车,可以用电动机、内燃机或二者结合推动车轮。汽车上坡或加速时,电动机提供推动力,降低汽油的消耗;在下坡时,电池处于充电状态。
(1)混合动力车目前一般使用镍氢电池,该电池中镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解质溶液。镍氢电池充放电原理如图1所示,其总反应式为H2+2NiOOH![]() 2Ni(OH)2。根据所给信息判断,混合动力车上坡或加速时,乙电极周围溶液的pH___ (填“增大”、“减小”或“不变”),该电极的电极反应式为___。
2Ni(OH)2。根据所给信息判断,混合动力车上坡或加速时,乙电极周围溶液的pH___ (填“增大”、“减小”或“不变”),该电极的电极反应式为___。
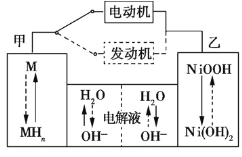
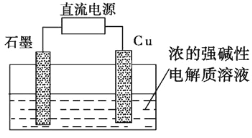
图1 图2
(2)Cu2O是一种半导体材料,可通过如图2所示的电解装置制取,电解总反应式为2Cu+H2O![]() Cu2O+H2↑,阴极的电极反应式是________。用镍氢电池作为电源进行电解,当电池中有1 mol H2被消耗时,Cu2O的理论产量为___g。
Cu2O+H2↑,阴极的电极反应式是________。用镍氢电池作为电源进行电解,当电池中有1 mol H2被消耗时,Cu2O的理论产量为___g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com