
【题目】常温下,用0.100 0 mol·L-1NaOH溶液滴定20.00 mL 0.100 0 mol·L-1CH3COOH溶液所得滴定曲线如图。下列说法正确的是( )

A.①所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-)
B.②所示溶液中:c(Na+)=c(CH3COO-)
C.③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D.滴定过程中可能出现:c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
【答案】B
【解析】
A.①点溶液中溶质为等物质的量浓度的CH3COOH和CH3COONa,存在物料守恒2c(Na+)=c(CH3COOH)+c(CH3COO-),故A错误;
B.②点溶液pH=7,溶液呈中性,则c(H+)=c(OH-),溶液中存在电荷守恒c(CH3COO-)+c(OH-)=c(H+)+c(Na+),根据电荷守恒得c(Na+)=c(CH3COO-),故B正确;
C.③点溶液中溶质为醋酸钠,醋酸根离子水解导致溶液呈碱性,但是其水解程度较小,所以存在c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故C错误;
D.加入的NaOH后,溶液中一定含有溶质醋酸钠,溶液中一定存在电荷守恒c(CH3COO-)+c(OH-)=c(H+)+c(Na+),所以不可能存在c(CH3COO-)>c(Na+)>c(OH-)>c(H+),故D错误;
故选B。


科目:高中化学 来源: 题型:
【题目】以软锰矿粉(主要含有MnO2,还含有少量的Fe2O3、Al2O3等杂质)为原料制备高纯MnO2的流程如下图所示:
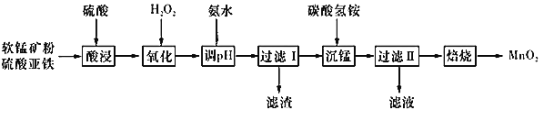
已知:①常温下,Ksp[Fe(OH)3]=8.0×10-38,Ksp [Al(OH)3]=4.0×10-34。
②常温下,氢氧化物沉淀的条件:Al3+、Fe3+完全沉淀的pH分别为4.6、3.4;Mn2+开始沉淀的pH为8.1。
③常温下,当溶液中金属离子物质的量浓度小于或等于1×10-5mol·L-l时,可视为该金属离子已被沉淀完全。
(1)实验室预计需要使用480 mL 2 mol·L-1的硫酸,准备用18.4 mol·L-1的浓硫酸来配制,需用量筒量取浓硫酸________mL;配制时所用玻璃仪器除量筒、烧杯和玻璃棒外,还需_______。
(2)加入硫酸亚铁的原因为_____________________________。
(3)“酸浸”过程中不能用浓盐酸替代硫酸,原因是_____________(用离子方程式表示)。“酸浸”时为加快反应速率可采取的措施是_____________________(至少写两个)。
(4)加入氨水应调节pH的范围为_______。“过滤II”所得滤渣为MnCO3,滤液中溶质的主要成分是_______(填化学式)
(5)加入碳酸氢铵产生沉淀的过程称为“沉锰”。
①“沉锰”过程中放出CO2,反应的离子方程式为_________。
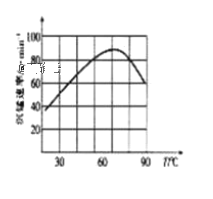
②“沉锰”过程中沉锰速率与温度的关系如图所示。当温度高于60℃时,沉锰速率随着温度升高而减慢的原因可能是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积一定的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:C(s)+2NO(g)![]() CO2(g)+N2(g),平衡时c(NO)与温度T的关系如图所示,则下列说法正确的是( )
CO2(g)+N2(g),平衡时c(NO)与温度T的关系如图所示,则下列说法正确的是( )
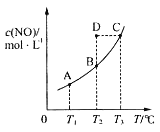
A.该反应的ΔH>0
B.若该反应在T1、T2℃时的平衡常数分别为K1、K2,则K1<K2
C.在T2℃时,若反应体系处于状态D,则此时v正>v逆
D.若状态B、C、D的压强分别为p(B)、p(C)、p(D),则p(C)=p(D)>p(B)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上合成CH3OH的原理为:2H2(g)+CO![]() CH3OH(g),一定温度下,向1L恒容密闭容器中充入H2和CO,反应达平衡时CH3OH的体积分数与反应物投料之比(n(H2)/n(CO))的关系如图所示。下列说法错误的是
CH3OH(g),一定温度下,向1L恒容密闭容器中充入H2和CO,反应达平衡时CH3OH的体积分数与反应物投料之比(n(H2)/n(CO))的关系如图所示。下列说法错误的是
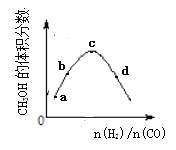
A. 相同条件下,达到平衡时混合气体的密度与反应前相同
B. a、b、c、d四点中,c点CO的转化率最大。
C. 若投料时n(CO)不变,a、b、c、d四点中d处CH3OH的物质的量最大
D. 图像中 c点到d点,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A 是石油裂解气的主要产物之一,其产量常用于衡量一个国家石油化工发展水平的标志。下列是有机物 A~G 之间的转化关系:
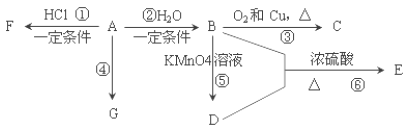
请回答下列问题:
(1)A 的官能团的名称是___________; C 的结构简式是________;
(2)E 是一种具有香味的液体, 由 B+D→E 的反应方程式为___________, 该反应类型是______________;
(3)G 是一种高分子化合物,其结构简式是______________;
(4)比赛中,当运动员肌肉挫伤或扭伤时,随队医生即对准受伤部位喷射物质 F(沸点 12.27°C)进行应急处理.写出由A 制 F 的化学反应方程式______________。
(5)E 的同分异构体能与 NaHCO3溶液反应,写出该同分异构体的结构简式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对滴有酚酞试液的下列溶液,操作后颜色变深的是
A. 明矾溶液加热 B. CH3COONa溶液加热
C. 氨水中加入少量NH4Cl固体 D. 小苏打溶液中加入少量NaCl固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T1时,在三个容积均为1L的恒容密闭容器中仅发生反应: 2NO2(g)![]() 2NO(g)+O2(g) (正反应吸热)。实验测得:v正=v(NO2)消耗=k正c2(NO2),v逆=v(NO)消耗= 2v(O2)消耗=k逆c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。
2NO(g)+O2(g) (正反应吸热)。实验测得:v正=v(NO2)消耗=k正c2(NO2),v逆=v(NO)消耗= 2v(O2)消耗=k逆c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。
下列说法正确的是
容器 编号 | 物质的起始浓度(mol·L-1) | 物质的平衡浓度(mol·L-1) | ||
c(NO2) | c(NO) | c(O2) | c(O2) | |
Ⅰ | 0.6 | 0 | 0 | 0.2 |
Ⅱ | 0.3 | 0.5 | 0.2 | |
Ⅲ | 0 | 0.5 | 0.35 | |
A. 设k为该反应的化学平衡常数,则有k=k逆:k正
B. 达平衡时,容器Ⅱ与容器Ⅲ中的总压强之比为20∶17
C. 容器Ⅱ中起始平衡正向移动,达平衡时,容器Ⅱ中NO2的转化率比容器Ⅰ中的小
D. 若改变温度为T2,且T2>T1,则k正:k逆<0.8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型![]() 燃料电池
燃料电池![]() 的结构如图,该电池总反应方程式为
的结构如图,该电池总反应方程式为![]() ,下列有关说法错误的是
,下列有关说法错误的是![]()

A.放电过程中,![]() 向B极区迁移
向B极区迁移
B.电池A极区的电极反应式为![]()
C.外电路中,电子的流向为B经过导线到A
D.在电池反应中,每消耗1L![]() 溶液,理论上流过电路中的电子数为
溶液,理论上流过电路中的电子数为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com