
【题目】运用所学知识,解决下列问题。
(1)AlCl3溶液呈___(填“酸”“中”或“碱”)性,原因是___(用离子方程式表示)。实验室配制AlCl3溶液时,常将AlCl3固体先溶于较浓的盐酸中,再用蒸熘水稀释到所需的浓度,目的是___。
(2)今有常温下五种溶液:CH3COONa溶液、NH4Cl溶液、NaOH溶液、氨水、NH4HSO4溶液。
①CH3COONa溶液pH___(填“>”“=”或“<” )7,若要使溶液的pH增大,可采取的措施是___。
②pH相等的NaOH溶液和CH3COONa溶液,分别稀释相同倍数后,NaOH溶液的pH___(填“>”“=”“<”)CH3COONa溶液。
③物质的量浓度均为0.1mol·L-1的三种溶液:A.NH4Cl溶液 B.NH4HSO4溶液 C.氨水,c(NH4+)由大到小的顺序为___(填字母)。
【答案】酸 Al3++3H2O![]() Al(OH)3+3H+ 抑制Al3+的水解 > 加入少量KOH固体 < B>A>C
Al(OH)3+3H+ 抑制Al3+的水解 > 加入少量KOH固体 < B>A>C
【解析】
(1)AlCl3为强酸弱碱盐,在水溶液中能够水解;
(2)①强碱弱酸盐,在溶液中水解,溶液显碱性,促进水解,或者增大c(OH-)均可使pH增大;
②CH3COONa为强碱弱酸盐,在水溶液中会水解,加入稀释,会促进水解,溶液的pH的变化小于强碱溶液pH的变化。
(1) AlCl3为强酸弱碱盐,在水溶液中能够水解,水解的离子方程式为Al3++3H2O![]() Al(OH)3+3H+,结合了水电离出来的OH-,使得溶液中的c(H+)>c(OH-),溶液呈现酸性。先将AlCl3溶于盐酸中,再稀释成相应的浓度,加入HCl,c(H+)增大,可以抑制Al3+水解;
Al(OH)3+3H+,结合了水电离出来的OH-,使得溶液中的c(H+)>c(OH-),溶液呈现酸性。先将AlCl3溶于盐酸中,再稀释成相应的浓度,加入HCl,c(H+)增大,可以抑制Al3+水解;
(2)①CH3COONa为强碱弱酸盐,CH3COO-在溶液中水解,CH3COOH-+H2O![]() CH3COOH+OH-,使得溶液中的c(OH-)>c(H+),溶液呈碱性,pH>7。要增大pH,可以促进CH3COO-水解,也可以直接增大c(OH-),可以向溶液中加入CH3COONa固体,可以升高温度,可以加入KOH固体等;
CH3COOH+OH-,使得溶液中的c(OH-)>c(H+),溶液呈碱性,pH>7。要增大pH,可以促进CH3COO-水解,也可以直接增大c(OH-),可以向溶液中加入CH3COONa固体,可以升高温度,可以加入KOH固体等;
②NaOH为强碱,在溶液中完全电离;CH3COONa为强碱弱酸盐,CH3COO-在溶液中水解,加入稀释,会促进水解,c(OH-)减小的程度小于NaOH溶液中c(OH-)减小的程度,则稀释相同倍数后,CH3COONa溶液中c(OH-)大于NaOH溶液中c(OH-),NaOH溶液的pH<CH3COONa溶液的pH;
③NH4Cl和NH4HSO4为强电解质,完全电离,而NH3·H2O为弱电解质,电离是微弱的,电离方程式为NH3·H2O![]() NH4++OH-,则氨水中的c(NH4+)最小;NH4Cl和NH4HSO4的溶液中NH4+会水解,NH4++H2O
NH4++OH-,则氨水中的c(NH4+)最小;NH4Cl和NH4HSO4的溶液中NH4+会水解,NH4++H2O![]() NH3·H2O+H+,NH4HSO4电离出来的H+会抑制NH4+的水解,则NH4Cl溶液中的c(NH4+)小于NH4HSO4溶液中的c(NH4+),综合排序为B>A>C。
NH3·H2O+H+,NH4HSO4电离出来的H+会抑制NH4+的水解,则NH4Cl溶液中的c(NH4+)小于NH4HSO4溶液中的c(NH4+),综合排序为B>A>C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】为探究一溴环己烷(![]() )与NaOH 的醇溶液共热发生的是水解反应还是消去反应,甲、乙、丙三位同学分别设计了如下三种实验方案。
)与NaOH 的醇溶液共热发生的是水解反应还是消去反应,甲、乙、丙三位同学分别设计了如下三种实验方案。
甲:向反应混合液中滴入稀硝酸中和NaOH 溶液,然后滴入AgNO3溶液,若有淡黄色沉淀生成,则可证明发生了消去反应。
乙:向反应混合液中滴入溴水,若溶液颜色很快褪去,则可证明发生了消去反应。
丙:向反应混合液中滴入酸性FeCl3溶液,若溶液颜色变为紫色,则可证明发生了水解反应。
其中正确的是( )
A.甲B.乙
C.丙D.上述实验方案都不正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,将20mL3xmol·L-1Na3AsO3、20mL3xmol·L-1I2和20mLNaOH溶液混合,发生反应:AsO33-(aq)+I2(aq)+2OH-(aq)![]() AsO43-(aq)+2I-(aq)+H2O(l)。溶液中c(AsO43-)与反应时间(t)的关系如图所示。
AsO43-(aq)+2I-(aq)+H2O(l)。溶液中c(AsO43-)与反应时间(t)的关系如图所示。
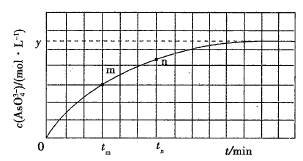
下列可判断反应达到平衡的是__(填标号)
a溶液的pH不再变化
b.v(I-)=2v(AsO33-)
c.![]() 不再变化
不再变化
d.c(I-)=ymol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验在学科中有着非常重要的作用,结合图示实验装置,下列相关分析的描述不正确的是( )
A.图1:盐桥中使用KCl溶液,电子的流向是Zn→G→Cu→CuSO4溶液→盐桥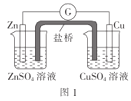
B.图2:可根据该实验验证铁的吸氧腐蚀
C.图3:在强酸和强碱的中和热实验中,强碱的浓度比强酸的略大
D.图4:根据两烧瓶中气体颜色的变化(热水中变深、冰水中变浅)可以判断反应2NO2(g)![]() N2O4(g)是一个放热反应
N2O4(g)是一个放热反应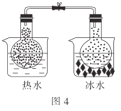
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1是铜锌原电池示意图。图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示( )
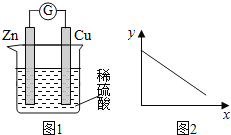
A. 铜棒的质量 B. c(Zn2+) C. c(H+) D. c(SO42-) -
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由多元素组成的化合物Fe-Sm-As-F-O是一种重要的铁系超导材料。下列说法正确的是
A.F的核外电子排布式1s22s22p7
B.Fe3+的轨道表示式![]() 违背了泡利不相容原理
违背了泡利不相容原理
C.N、As同主族,第一电离能N<As
D.电负性F>O>As
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,分别在下列容积为2L的恒容绝热密闭容器中,发生如下反应: 2CO(g)+SO2(g)=S(g)+2CO2(g) △H>0。测得相关数据如下表所示。
容器 | 起始时物质的量 | 平衡时CO(g)的浓度/mol·L | |||
CO(g) | SO2(g) | S(g) | CO2(g) | ||
甲 | 1 | 0.5 | 0.5 | 1 | a |
乙 | 1 | 0.5 | 0 | 0 | 0.2 |
丙 | 0 | 0 | 1 | 2 | b |
下列说法正确的是
A.平衡常数:K甲>K乙
B.a=0.4
C.若乙容器l0min达到平衡.则用S(g)表示的反应速率为0.005molL-1min-1
D.若将丙容器改为恒压绝热容器,则达到平衡时b=0.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.4 L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题。
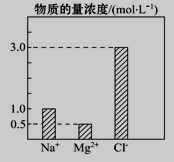
(1)该混合液中,NaCl的物质的量为________mol,含溶质MgCl2的质量为________g。
(2)该混合液中CaCl2的物质的量为_________mol,将该混合液加水稀释至体积为1L,稀释后溶液中Ca2+的物质的量浓度为___________mol·L-1。
(3)向该稀释后的溶液中加入足量硝酸酸化的硝酸银溶液,可得到沉淀__________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物![]() (甲)、
(甲)、![]() (乙)、
(乙)、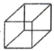 (丙)的分子式均为C8H8,下列说法不正确的是( )
(丙)的分子式均为C8H8,下列说法不正确的是( )
A.甲、乙、丙在空气中燃烧时均产生明亮的火焰并伴有浓烟
B.甲、乙、丙中只有甲的所有原子可能处于同一平面
C.等物质的量的甲和乙分别与足量的溴水反应,消耗Br2的量:甲![]() 乙
乙
D.三者中二氯代物数目最少的是丙
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com