
【题目】某研究小组为了验证反应物浓度对反应速率的影响,选用硫酸酸化的高锰酸钾溶液与草酸H2C2O4溶液在室温下进行反应。实验中所用的草酸为稀溶液,视为强酸。
(1)写出硫酸酸化的高锰酸钾氧化稀草酸溶液的离子方程式__________。
(2)该小组进行了实验I,数据如下。
H2SO4溶液 | KMnO4溶液 | H2C2O4溶液 | 褪色时间(分:秒) |
1mL 2mol/L | 2mL 0.01mol/L | 1mL 0.1mol/L | 2:03 |
1mL 2mol/L | 2mL 0.01mol/L | 1mL 0.2mol/L | 2:16 |
一般来说,其他条件相同时,增大反应物浓度,反应速率___________(填“增大”或“减小”)。但分析该实验数据,得到的结论是在当前实验条件下,增大草酸浓度,反应速率减小。
(3)该小组欲探究出现上述异常现象的原因,在实验I的基础上,只改变草酸溶液浓度进行了实验II,获得实验数据并绘制曲线图如下。

该小组查阅资料获取如下信息,其中能够解释MO变化趋势的是___________。
a | KMnO4与H2C2O4反应是分步进行的,反应过程中生成Mn(VI)、Mn(III)、Mn(IV),最终变为无色的Mn(II)。(括号中罗马数字表示锰的化合价) |
b | 草酸根易与不同价态锰离子形成较稳定的配位化合物。 |
c | 草酸稳定性较差,加热至185℃可分解。 |
(4)该小组为探究ON段曲线变化趋势的原因,又进行了实验III,所得数据如下。
H2SO4溶液 | Na2SO4固体 | KMnO4溶液 | H2C2O4溶液 | 褪色时间(分:秒) |
1mL 0.1mol/L | 1.9×10-3mol | 2mL 0.01mol/L | 1mL 0.2mol/L | 16:20 |
1mL 0.5mol/L | 1.5×10-3mol | 2mL 0.01mol/L | 1mL 0.2mol/L | 8:25 |
1mL 1.0mol/L | 1.0×10-3mol | 2mL 0.01mol/L | 1mL 0.2mol/L | 6:15 |
1mL 2.0mol/L | 0 | 2mL 0.01mol/L | 1mL 0.2mol/L | 2:16 |
该小组进行实验III的目的是____________________________________________。
(5)综合实验I、II、III,推测造成曲线MN变化趋势的原因________________。
a.当草酸浓度较小时,C2O42-起主要作用,草酸浓度越大,反应速率越小
b.当草酸浓度较小时,H+起主要作用,草酸浓度越大,反应速率越大
c.当草酸浓度较大时,C2O42-起主要作用,草酸浓度越大,反应速率越小
d.当草酸浓度较大时,H+起主要作用,草酸浓度越大,反应速率越大
【答案】2MnO4- +5C2O42-+16H+===2Mn2+ +10CO2↑+8H2O 增大 ab 探究其他离子浓度不变,溶液中H+浓度对反应速率的影响 ad
【解析】
(1)酸性条件下高锰酸根离子和草酸根离子发生氧化还原反应,根据元素守恒知,生成物中生成水,该反应中Mn元素化合价由+7价变为+2价、C元素化合价由+3价变为+4价,根据转移电子守恒、原子守恒配平方程式。
(2)一般来说,其他条件相同时,增大反应物浓度,反应速率增大。
(3)据MO变化趋势,得出反应速率随着草酸浓度增加而减小,可能原因是KMnO4与H2C2O4反应是分步进行的,反应过程中生成Mn(VI)、Mn(III)、Mn(IV),最终变为无色的Mn(II),以及草酸根易与不同价态锰离子形成较稳定的配位化合物,据此进行分析。
(4)小组进行实验III的目的是探究其他离子浓度不变,溶液中H+浓度对反应速率的影响。
(5)当草酸浓度较小时,C2O42﹣起主要作用,草酸浓度越大,反应速率越小;当草酸浓度较大时,H+起主要作用,使得草酸浓度越大,反应速率越大。
(1)酸性条件下高锰酸根离子和草酸根离子发生氧化还原反应,根据元素守恒知,生成物中有生成水,该反应中Mn元素化合价由+7价变为+2价、C元素化合价由+3价变为+4价,转移电子数为10,根据转移电子守恒、原子守恒配平方程式得2MnO4﹣+5C2O42﹣+16H+=2Mn2++10CO2↑+8H2O,故答案为:2MnO4﹣+5C2O42﹣+16H+=2Mn2++10CO2↑+8H2O。
(2)一般来说,其他条件相同时,增大反应物浓度,反应速率增大,故答案为:增大。
(3)MO变化趋势,得出反应速率随着草酸浓度增加而减小,可能原因是KMnO4与H2C2O4反应是分步进行的,反应过程中生成Mn(VI)、Mn(III)、Mn(IV),最终变为无色的Mn(II),以及草酸根易与不同价态锰离子形成较稳定的配位化合物。
故答案为:ab。
(4)小组进行实验III的目的是探究其他离子浓度不变,溶液中H+浓度对反应速率的影响,
故答案为:探究其他离子浓度不变,溶液中H+浓度对反应速率的影响。
(5)当草酸浓度较小时,C2O42﹣起主要作用,草酸浓度越大,反应速率越小;当草酸浓度较大时,H+起主要作用,使得草酸浓度越大,反应速率越大。故选ad。


科目:高中化学 来源: 题型:
【题目】下列事实不能证明甲酸(HCOOH,一元酸)为弱酸的是( )
A.0.1mol/L甲酸的pH为2.3
B.将pH=2的甲酸稀释100倍后,溶液的pH小于4
C.温度升高,溶液的导电能力增强
D.等体积等浓度的甲酸和HCl与足量的锌反应,产生等量的氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年5月9 日中国科学院正式向社会发布113号、115号、117号和118号元素的中文名称。已知117号元素有多种原子,如![]() 、
、![]() 等。下列说法正确的是( )
等。下列说法正确的是( )
A.![]() 和
和![]() 的化学性质不同
的化学性质不同
B.Ts位于周期表的第六周期ⅦA族
C.元素Ts的相对原子质量为293.5
D.![]() 和
和![]() 质子数相同,中子数不同
质子数相同,中子数不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在盛有足量A的体积可变的密闭容器中,加入B,发生反应:A(s)+2B(g)![]() 4C(g)+D(g)ΔH<0。在一定温度、压强下达到平衡。平衡时C的物质的量与加入的B的物质的量的变化关系如图。下列说法正确的是
4C(g)+D(g)ΔH<0。在一定温度、压强下达到平衡。平衡时C的物质的量与加入的B的物质的量的变化关系如图。下列说法正确的是

A. 当温度升高后,则图中θ>45°
B. 若再加入B,再次达到平衡状态时,正、逆反应速率均增大
C. 平衡时B的转化率为50%
D. 若再加入B,则平衡后反应体系气体密度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Bodensteins研究反应H2(g)+I2(g)![]() 2HI(g),温度为T时,在两个体积均为1 L的密闭容器中进行实验,测得气体混合物中碘化氢的物质的量分数w (HI)与反应时间t的关系如下表:
2HI(g),温度为T时,在两个体积均为1 L的密闭容器中进行实验,测得气体混合物中碘化氢的物质的量分数w (HI)与反应时间t的关系如下表:
容器编号 | 起始物质 | t/min | 0 | 20 | 40 | 60 | 80 | 100 |
I | 0.5 mol I2、0.5 mol H2 | w (HI)/% | 0 | 50 | 68 | 76 | 80 | 80 |
II | x mol HI | w (HI)/% | 100 | 91 | 84 | 81 | 80 | 80 |
研究发现上述反应中:v正=ka·w(H2)·w(I2),v逆=kb·w2(HI),其中ka、kb为常数。下列说法正确的是:
A. 温度为T时,该反应![]()
B. 容器I中在前20 min的平均速率v(HI)=0.0125 mol·L-1·min-1
C. 若起始时向容器I中加入物质的量均为0.1 mol的H2、I2、HI,反应逆向进行
D. 若两容器中存在kaⅠ= kaⅡ且kbⅠ= kbⅡ,则x的值可以为任何值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=2的A、B两种酸溶液各1 mL,分别加水稀释到1000 mL,其中pH与溶液体积V的关系如图所示。下列说法正确的是( )

A. A、B两酸溶液的物质的量浓度一定相等
B. 稀释后,A酸溶液的酸性比B酸溶液强
C. a=5时,A是强酸,B是弱酸
D. 若a小于5,则A、B都是弱酸,且A的酸性弱于B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】脱除烟气中的氮氧化物(主要是指NO和NO2)可以净化空气、改善环境,是环境保护的主要课题。
(1)以漂粉精溶液为吸收剂脱除烟气中的NO,相关热化学方程式如下:
ⅰ.4NO(g) + 3O2(g) + 2H2O(l) = 4HNO3(aq) H1 =﹣423 kJ·mol-1
ⅱ.Ca(ClO)2(aq) = CaCl2(aq) + O2(g) H2 =﹣120 kJ·mol-1
ⅲ.3Ca(ClO)2(aq) + 4NO(g) + 2H2O(l) = 4HNO3(aq) + 3CaCl2(aq) H3
① H3 = _______kJ·mol-1 。
② 反应ⅲ的平衡常数随温度升高的变化趋势是________。
(2)HClO可有效脱除NO,但HClO不稳定,实际应用中常用其盐。C12和Ca(OH)2制取漂粉精的化学方程式是________。
(3)次氯酸盐脱除NO的主要过程如下:
a.NO+HClO = NO2+HCl
b.NO + NO2+H2O 2HNO2
c.HClO+ HNO2 = HNO3+HCl
下列分析正确的是________。
A.烟气中含有的少量O2能提高NO的脱除率
B.NO2单独存在时不能被脱除
C.脱除过程中,次氯酸盐溶液的pH下降
(4)研究不同pH、不同温度下漂粉精溶液对NO脱除率的影响,结果如图1、图2。
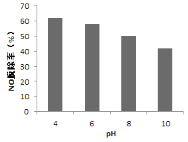

图1 图2
① 图1中,pH降低NO脱除率增大的原因:________。
② 脱除过程中往往有Cl2产生,原因是________(用离子方程式表示)。
③ 图2中,60~80℃ NO脱除率下降的原因:________。(至少答出两点)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示![]() 、
、![]() 装置电解氯化铜溶液和饱和食盐水。下列判断错误的是( )
装置电解氯化铜溶液和饱和食盐水。下列判断错误的是( )

A. 阳极失电子的离子相同、产物相同
B. 阴极产物因得电子的离子不同而不同
C. 电解后两装置中溶液的pH都减小
D. 电解后只有![]() 装置阴极的质量增加
装置阴极的质量增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,A是由X和Y两种短周期元素组成的气体,X的原子序数小于Y,甲、乙、丙分别是X、Y、Z元素对应的单质,Z是地壳中含量最高的元素,它们有如右图所示的转化关系。下列说法不正确的是

A. X、Y、Z三种元素能组成离子化合物
B. 反应②为化合反应,反应③为置换反应
C. 常温常压下,Z的简单氢化物的熔沸点为同族最高
D. 原子半径:Y>Z>X
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com