
【题目】已知:25℃时,0.1000mol·L-lCH3COOH溶液中CH3COOH的电离度(×100%)约为1%。该温度下,用0.1000mol·L-l氨水滴定10.00mL0.1000mol·L-lCH3COOH溶液,溶液的pH与溶液的导电能力(I)的关系如图所示。下列说法中正确的是( )
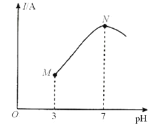
A.M点→N点,水的电离程度逐渐增大
B.25℃时,CH3COOH 的电离常数约为1.0×10-2
C.N点溶液中,c(CH3COO-)>c(NH4+)
D.当滴入20 mL氨水时,溶液中c(CH3COO-)>c(NH4+)
【答案】A
【解析】
A.醋酸溶液中加入氨水,二者反应生成醋酸铵和水,醋酸的电离出的氢离子浓度减小,对水的电离的抑制作用减弱,故正确;
B. 25℃时0.1000mol·L-lCH3COOH溶液中CH3COOH的电离度(×100%)约为1%,则根据电离平衡常数计算,醋酸电离平衡常数为![]() ,故错误;
,故错误;
C.N点溶液为中性,则有c(H+)=c(OH-),根据电荷守恒c(NH4+)+c(H+)=c(OH-)+ c(CH3COO-)分析,有c(CH3COO-)=c(NH4+),故错误;
D. 当滴入20 mL氨水时,溶液为等浓度的氨水和醋酸铵,溶液为碱性,根据电荷守恒c(NH4+)+c(H+)=c(OH-)+ c(CH3COO-)和c(H+)<c(OH-)分析,有c(CH3COO-)<c(NH4+),故错误。
故选A。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法正确的是
A.常温下,10 mL pH=1的醋酸溶液中含有的氢离子数为0.001NA
B.合成氨反应中,1 mol N2与4 mol H2反应生成的NH3分子数为2NA
C.用碱性锌锰干电池作电源电解饱和食盐水,当消耗MnO2 8.7g时,可制得标况下氯气2.24L(不考虑氯气的溶解;电池工作时MnO2转化为MnOOH)
D.常温常压下,18.4 g NO2和N2O4的混合气体中含有的氮原子总数为0.8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.1mol/LNaOH和0.1mol/LNH4Cl溶液等体积混合后,离子浓度大小正确的次序是( )
A.c(Na+)>c(Cl-)>c(OH-)>c(H+)
B.c(Na+)=c(Cl-)>c(OH-)>c(H+)
C.c(Na+)=c(Cl-)>c(H+)>c(OH-)
D.c(Cl-)>c(Na+)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.将纯水加热的过程中,Kw变大、pH变小
B.配制FeSO4溶液时,加入稀HNO3抑制Fe2+水解
C.FeCl3溶液蒸干、灼烧至恒重,最终得到FeCl3固体
D.向0.1mol/L氨水中加入少量水,溶液中![]() 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种主族元素的离子aXm+、bYn+、cZn-和dRm-(a、b、c、d为元素的原子序数),它们具有相同的电子层结构,若m>n,对下列叙述的判断正确的是( )
①a-b=n-m
②元素的原子序数a>b>c>d
③元素非金属性Z>R
④最高价氧化物对应水化物碱性X>Y
A.③B.①②③④C.①②③D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置为锂钒氧化物二次电池,其成本较低,且对环境无污染:V2O5+xLi![]() LixV2O5;在图中用该电池电解含镍酸性废水可得到单质镍。下列说法正确的是
LixV2O5;在图中用该电池电解含镍酸性废水可得到单质镍。下列说法正确的是
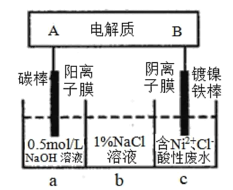
A.该电池充电时,B电极的电极反应式为:LixV2O5-xe-=V2O5+xLi+
B.锂钒氧化物二次电池可以用LiCl水溶液作为电解液
C.电解过程中,b中NaCl溶液的物质的量浓度会增大
D.当锂钒氧化物二次电池中有7gLi参与放电时,转移电子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如下:
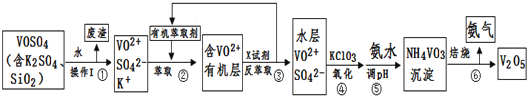
请回答下列问题:
(1)步骤①所得废渣的成分是____________写化学式),操作I的名称______。
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n(水层)+ 2nHA(有机层)![]() 2RAn(有机层) + nH2SO4 (水层)
2RAn(有机层) + nH2SO4 (水层)
②中萃取时必须加入适量碱,其原因是____________________________。
③中X试剂为___________________。
(3)⑤的离子方程式为________________________。
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为__________;
若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)<_____________。
(已知:25℃时,Ksp[Fe(OH)3]=2.6×10-39)
(5)该工艺流程中,可以循环利用的物质有______________和_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】针对下图装置的说法中正确的是( )

A. 溶液中pH明显下降
B. 铁片为正极,镀锌铁片为负极
C. 铁片的电极反应式:Fe-2e-=Fe2+
D. 电子由锌经溶液流向铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关溶液性质的叙述,正确的是 ( )
A.室温时饱和的二氧化碳水溶液,冷却到0℃时会放出一些二氧化碳气体
B.20℃,100g水可溶解34.2g KCl,此时KCl饱和溶液的质量分数为34.2%
C.强电解质在水中溶解度一定大于弱电解质
D.相同温度下,把水面上的空气换成相同压力的纯氧,100g水中溶入氧气的质量增加
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com