
【题目】工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如下:
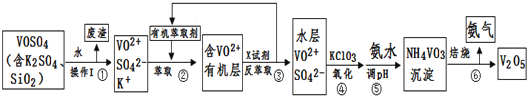
请回答下列问题:
(1)步骤①所得废渣的成分是____________写化学式),操作I的名称______。
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n(水层)+ 2nHA(有机层)![]() 2RAn(有机层) + nH2SO4 (水层)
2RAn(有机层) + nH2SO4 (水层)
②中萃取时必须加入适量碱,其原因是____________________________。
③中X试剂为___________________。
(3)⑤的离子方程式为________________________。
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为__________;
若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)<_____________。
(已知:25℃时,Ksp[Fe(OH)3]=2.6×10-39)
(5)该工艺流程中,可以循环利用的物质有______________和_______。
【答案】SiO2 过滤 加入碱中和硫酸,促使平衡正向移动,提高钒的萃取率[或类似表述,如提高RAn(有机层)的浓度、百分含量等] H2SO4 NH3·H2O+VO3- =NH4VO3↓+OH- 1.7~1.8(或1.7、1.8其中一个) 2.6×10-3mol·L-1 氨气(或氨水) 有机萃取剂
【解析】
将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程,水溶过滤得到含VO2+、SO42-、K+的溶液,加入有机萃取剂分液得到含VO2+的有机层,再经过反萃取得到水层,加入KClO3氧化VO2+为VO3-,加入氨水调节溶液PH形成NH4VO3沉淀,灼烧得到V2O5,以此分析解答;
(1)含有K2SO4、SiO2杂质VOSO4水溶后,二氧化硅不溶于水,过滤得到滤渣为二氧化硅;
(2)③中反萃取时加入的X试剂是抑制平衡正向进行;
(3)依据氨水与VO3-反应配平得到离子方程式;
(4)根据表中数据判断,⑤中加入氨水,调节溶液pH最佳值为1.8,此时钡沉淀率达到最大,需要氨水量较小;依据沉淀溶度积计算分析;
(5)分析流程图,物质参加反应,反应过程中又生成可以循环利用.
(1)对比操作I前后的物质,可以判断VOSO4、K2SO4是易溶易电离的盐,而二氧化硅是难溶于水的酸性氧化物,因此滤渣的主要成分是SiO2;操作I的目的是从混合物中分离滤渣和溶液,说明I是过滤;
(2)加入碱,碱能中和硫酸,减小硫酸浓度,使R2(SO4)n(水层)+ 2nHA(有机层)![]() 2RAn(有机层)+ nH2SO4 (水层)的平衡向正反应方向移动,提高钒的萃取率[或类似表述,如提高RAn(有机层)的浓度、百分含量、充分溶解等];加入X试剂的目的是得到有机萃取剂HA,因此需要使R2(SO4)n(水层)+ 2nHA(有机层)
2RAn(有机层)+ nH2SO4 (水层)的平衡向正反应方向移动,提高钒的萃取率[或类似表述,如提高RAn(有机层)的浓度、百分含量、充分溶解等];加入X试剂的目的是得到有机萃取剂HA,因此需要使R2(SO4)n(水层)+ 2nHA(有机层)![]() 2RAn(有机层)+ nH2SO4 (水层)的平衡向逆反应方向移动,且不能引入新的杂质,因此X为硫酸;
2RAn(有机层)+ nH2SO4 (水层)的平衡向逆反应方向移动,且不能引入新的杂质,因此X为硫酸;
(3)加入氨水提高溶液的pH至1.7~1.8之间时,首先氨水与酸中和生成铵根离子,接着铵根离子与钒酸根离子结合生成钒酸铵沉淀,即NH3·H2O+H+ = NH4++H2O,NH4++VO3- =NH4VO3↓或NH3·H2O+VO3- =NH4VO3↓+OH-或NH3·H2O+VO3-+H+ =NH4VO3↓+ H2O;
(4)读表,pH至1.7~1.8之间时,钒沉淀率最高,达到98.8%;根据钒沉淀率和溶液pH之间关系,若钒沉淀率为93.1%,则溶液pH=2.0,则c(H+)=10-2mol/L,由于常温下水的离子积为1.0×10-14,c(OH-)=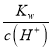 =10-12mol/L,若不产生Fe(OH)3沉淀,则Qc<Ksp,则c(Fe3+)c3(OH-)< 2.6×10-39,则c(Fe3+)< 2.6×10-3mol/L;
=10-12mol/L,若不产生Fe(OH)3沉淀,则Qc<Ksp,则c(Fe3+)c3(OH-)< 2.6×10-39,则c(Fe3+)< 2.6×10-3mol/L;
(5)图中萃取步骤消耗有机萃取剂,反萃取步骤生成有机萃取剂,因此有机萃取剂HA可以循环利用;图中调pH需要消耗氨水,焙烧时生成氨气,为了防止污染环境,氨气回收变为氨水,因此氨气或氨水可以循环利用。


 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的数值。下列说法正确的是
为阿伏加德罗常数的数值。下列说法正确的是![]()
![]()
A.![]() 与足量的Mg充分反应,转移的电子数为
与足量的Mg充分反应,转移的电子数为![]()
B.![]() 时,
时,![]() 的
的![]() 中含有
中含有![]() 的数目为
的数目为![]()
C.![]() 加热充分分解,产物中含有的
加热充分分解,产物中含有的![]() 分子数目为
分子数目为![]()
D.标准状况下,![]() 由氦气和氢气组成的混合气体中含有的原子总数为
由氦气和氢气组成的混合气体中含有的原子总数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向NaBr、NaI、Na2SO3混合液中,通入过量氯气后,将溶液蒸干并充分灼烧,得到固体剩余物质的组成可能是 ( )
A.NaCl Na2SO4
B.NaCl NaBr Na2SO4
C.NaCl Na2SO4 I2
D.NaCl NaI Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25℃时,0.1000mol·L-lCH3COOH溶液中CH3COOH的电离度(×100%)约为1%。该温度下,用0.1000mol·L-l氨水滴定10.00mL0.1000mol·L-lCH3COOH溶液,溶液的pH与溶液的导电能力(I)的关系如图所示。下列说法中正确的是( )
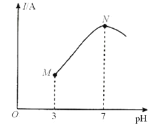
A.M点→N点,水的电离程度逐渐增大
B.25℃时,CH3COOH 的电离常数约为1.0×10-2
C.N点溶液中,c(CH3COO-)>c(NH4+)
D.当滴入20 mL氨水时,溶液中c(CH3COO-)>c(NH4+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分类方法在化学学科的发展中起了非常重要的作用,如图是某反应在密闭容器中反应前后的分子状况示意图,![]() 和
和![]() 分别表示不同的原子。对此反应的分类不正确的是( )
分别表示不同的原子。对此反应的分类不正确的是( )
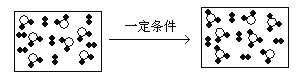
A.化合反应B.加成反应C.可逆反应D.氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.以石墨作电极电解AlCl3溶液:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
B.Fe(OH)3与过量的HI溶液:Fe(OH)3+3H+=Fe3++3H2O
C.NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O
D.NaHSO4溶液与Ba(OH)2溶液混合:SO42-+Ba2+=BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:298K时,Ksp(MnS)=4.65×10-14,Ksp(MnCO3)=2.24×10-11。298K时,MnS、MnCO3在水中沉淀溶解平衡曲线如图所示。下列说法正确的是( )

A.图像中e点处溶液c(Mn2+)≈5.0×10-6
B.常温下,加水稀释X溶液可使d点转移到f点
C.其他条件不变,加热含Y固体的Y溶液可使e点升到f点
D.在MnS和MnCO3饱和溶液中加少量MnCl2,![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pAg=-lgc(Ag+),pX=-lg c(Xn-)。298K时,几种物质的Ksp如下表:
化学式 | AgCl | AgSCN | Ag2CrO4 |
颜色 | 白 | 浅黄 | 红 |
Ksp | 1.8×1010 | 1.0×1012 | 2.0×1012 |
AgCl、AgSCN、Ag2CrO4的饱和溶液中,阳离子和阴离子的浓度关系如图所示。下列说法正确的是
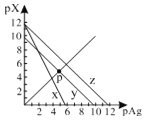
A.图中x代表AgCl曲线,z代表AgSCN曲线
B.298K时,在Cl-和CrO42-的物质的量浓度均为0.1mol/L的溶液中,滴入少量0.1mol/L的AgNO3溶液,首先产生的是红色沉淀
C.298K时若增大p点的阴离子浓度,则y上的点沿曲线向上移动
D.298K时Ag2CrO4(s)+2SCN-(aq) ![]() 2AgSCN(s)+CrO42- (aq)的平衡常数K=2.0×1012
2AgSCN(s)+CrO42- (aq)的平衡常数K=2.0×1012
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.100molL-1的NH4SCN溶液滴定25.00mL0.100molL-1AgNO3溶液,以NH4Fe(SO4)212H2O为指示剂,测得溶液中pSCN=lgc(SCN-)、pAg=lgc(Ag+)随加入NH4SCN溶液的体积变化如图所示。已知:Ag++SCN-AgSCN↓,Ksp(Ag2SO4)=1.4×10-5。下列说法错误的是( )

A.滴定至终点时溶液颜色变为红色,且振荡后不褪色
B.该温度下AgSCN的溶度积常数Ksp=1.0×10-12
C.为防止指示剂失效,溶液应维持酸性
D.当加入15.00mLNH4SCN溶液时,溶液中c(SO42-)=0.14molL-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com