
【题目】设![]() 为阿伏加德罗常数的数值。下列说法正确的是
为阿伏加德罗常数的数值。下列说法正确的是![]()
![]()
A.![]() 与足量的Mg充分反应,转移的电子数为
与足量的Mg充分反应,转移的电子数为![]()
B.![]() 时,
时,![]() 的
的![]() 中含有
中含有![]() 的数目为
的数目为![]()
C.![]() 加热充分分解,产物中含有的
加热充分分解,产物中含有的![]() 分子数目为
分子数目为![]()
D.标准状况下,![]() 由氦气和氢气组成的混合气体中含有的原子总数为
由氦气和氢气组成的混合气体中含有的原子总数为![]()
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A.向NaHCO3溶液中加入足量的Ba(OH)2:2HCO3-+Ba2++2OH-=BaCO3↓+ CO32-+2H2O
B.向亚硫酸钠溶液中滴入少量新制的氯水:3SO32-+ Cl2+H2O= SO42-+2Cl-+2HSO3-
C.电解KI溶液阴极电极反应2H2O-4e-= O2↑+4H+
D.Fe2O3固体投入到少量HI溶液中:Fe2O3+6H++6I-=2Fe2++3I2+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 代表阿伏加德罗常数的值,下列有关说法正确的是
代表阿伏加德罗常数的值,下列有关说法正确的是![]()
![]()
A.![]() 冰醋酸晶体中,含阴离子数目为
冰醋酸晶体中,含阴离子数目为![]()
B.标准状况下,![]() 中含有分子的数目为
中含有分子的数目为![]()
C.常温下,![]() 与
与![]() 混合气体中含分子数为
混合气体中含分子数为![]()
D.![]() 投入
投入![]() 的浓硝酸中,充分反应后转移电子数为
的浓硝酸中,充分反应后转移电子数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法正确的是
A.常温下,10 mL pH=1的醋酸溶液中含有的氢离子数为0.001NA
B.合成氨反应中,1 mol N2与4 mol H2反应生成的NH3分子数为2NA
C.用碱性锌锰干电池作电源电解饱和食盐水,当消耗MnO2 8.7g时,可制得标况下氯气2.24L(不考虑氯气的溶解;电池工作时MnO2转化为MnOOH)
D.常温常压下,18.4 g NO2和N2O4的混合气体中含有的氮原子总数为0.8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质之一。
(1)合成甲醇的反应为:CO(g)+2H2(g)![]() CH3OH(g);下图表示某次合成实验过程中甲醇的体积分数φ(CH3OH)与反应温度的关系曲线,则该反应的△H__________0。(填“>、<或=”下同)
CH3OH(g);下图表示某次合成实验过程中甲醇的体积分数φ(CH3OH)与反应温度的关系曲线,则该反应的△H__________0。(填“>、<或=”下同)

(2)在某温度下,向一个容积不变的密闭容器中通入2.5mol CO和7.5mol H2,达到平衡时CO的转化率为90%,此时容器内的压强为开始时的__________倍。
(3)利用甲醇燃料电池设计如图所示的装置:

①则该装置中b为____________极,写出装置中电解池内发生反应的离子方程式_______________________。
②当锌片的质量变化为12.8 g时,a极上消耗的O2 在标准状况下的体积为___________L。
(4)低碳经济是以低能耗、低污染、低排放为基础的经济模式,其中一种技术是将CO2转化成有机物实现碳循环。如:
2CO2(g)+2H2O(l)= C2H4(g)+3O2(g) ΔH=+1411.0 kJ/mol
2CO2(g)+3H2O(l)= C2H5OH(1)+3O2(g) ΔH=+1366.8 kJ/mol
则由乙烯水化制乙醇反应的热化学方程式____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某可逆反应aA+bB![]() cC在某温度下的平衡常数为K(K≠1),反应热为ΔH。保持温度不变,将方程式的书写作如下改变,则ΔH和K数值的相应变化为( )
cC在某温度下的平衡常数为K(K≠1),反应热为ΔH。保持温度不变,将方程式的书写作如下改变,则ΔH和K数值的相应变化为( )
A.写成2aA+2bB![]() 2cC,ΔH值、K值均扩大了一倍
2cC,ΔH值、K值均扩大了一倍
B.写成2aA+2bB![]() 2cC,ΔH值扩大了一倍,K值保持不变
2cC,ΔH值扩大了一倍,K值保持不变
C.写成cC![]() aA+bB,ΔH值、K值变为原来的相反数
aA+bB,ΔH值、K值变为原来的相反数
D.写成cC![]() aA+bB,ΔH值变为原来的相反数,K值变为原来的倒数
aA+bB,ΔH值变为原来的相反数,K值变为原来的倒数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应COCl2(g)![]() CO(g)+Cl2(g) ΔH>0,达到平衡时,下列措施:
CO(g)+Cl2(g) ΔH>0,达到平衡时,下列措施:
①升温 ②恒容通入惰性气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是( )
A.①②④B.①④⑥C.②③⑤D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.1mol/LNaOH和0.1mol/LNH4Cl溶液等体积混合后,离子浓度大小正确的次序是( )
A.c(Na+)>c(Cl-)>c(OH-)>c(H+)
B.c(Na+)=c(Cl-)>c(OH-)>c(H+)
C.c(Na+)=c(Cl-)>c(H+)>c(OH-)
D.c(Cl-)>c(Na+)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如下:
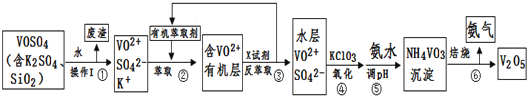
请回答下列问题:
(1)步骤①所得废渣的成分是____________写化学式),操作I的名称______。
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n(水层)+ 2nHA(有机层)![]() 2RAn(有机层) + nH2SO4 (水层)
2RAn(有机层) + nH2SO4 (水层)
②中萃取时必须加入适量碱,其原因是____________________________。
③中X试剂为___________________。
(3)⑤的离子方程式为________________________。
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为__________;
若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)<_____________。
(已知:25℃时,Ksp[Fe(OH)3]=2.6×10-39)
(5)该工艺流程中,可以循环利用的物质有______________和_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com