
【题目】下列关于油脂的结构 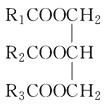 的说法正确的是( )
的说法正确的是( )
A.油脂是高级脂肪酸与甘油生成的酯
B.若R1、R2、R3都是饱和烃基,称为简单甘油酯
C.若R1、R2、R3都是不饱和烃基,称为混合甘油酯
D.某油脂分子中,所含烃基有三种,但每一个油脂分子中所含这三种烃基都相同,而且排列结构也相同,则该油脂为混合物
 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源: 题型:
【题目】食品安全已成为近几年来社会关注的热点问题之一。下列有关食品添加剂使用的说法正确的是( )
A.为了调节食品色泽,改善食品外观,使用工业色素苏丹红
B.为了提高奶粉中氮含量,加入适量的三聚氰胺
C.为了防止食品腐败,加入适量苯甲酸钠以达到阻抑细菌繁殖的作用
D.食盐是咸味剂,无防腐作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数值,下列说法不正确的是( )
A.10 g D216O中所含中子数为5NA
B.标准状况下,22.4 L乙烷中所含共价键数目为7NA
C.7.8g Na2O2中所含阴、阳离子总数目为0.4NA
D.密闭容器中,1 mol N2和3 mol H2充分反应后,容器中的分子数一定大于2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是一个巨大的化学资源宝库,利用海水可以获得很多化工产品.
(1)海水中制得的氯化钠可用于生产烧碱及氯气.反应的离子方程式是 .
(2)利用制盐后的盐卤提取溴的工艺流程如下(部分操作和条件已略去): ![]()
将Br2与Na2CO3反应的化学方程式补充完整:Br2+Na2CO3═NaBrO3++
(3)盐卤蒸发冷却后析出卤块的主要成分是MgCl2 , 此外还含Fe2+、Fe3+、Mn2+等离子.以卤块为原料制得镁的工艺流程如下(部分操作和条件已略去): 
生成氢氧化物沉淀的pH
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Mn(OH)2 | 8.3 | 9.8 |
Mg(OH)2 | 9.6 | 11.1 |
①步骤②中需控制pH=9.8,其目的是 .
②用NaClO 氧化Fe2+得到Fe(OH)3沉淀的离子反应方程式是 .
③步骤③需在HCl保护气中加热进行,其原理涉及的离子方程式为 .
④NaClO还能除去盐卤中的CO(NH2)2 , 生成盐类物质和能参与大气循环的物质.除去0.1mol CO(NH2)2时消耗NaClOg.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化亚铜是大型水面舰艇防护涂层的重要原料.某小组通过查阅资料,进行如下研究. 
已知 ![]() 碱性条件下氧化为
碱性条件下氧化为 ![]() .
.
Ⅰ:Cu2O的制取
(1)可以用葡萄糖还原法制Cu2O,是因为葡萄糖分子中含有(填官能团名称).
(2)实验室用此方法制取并获得少量Cu2O固体,需要的玻璃仪器除试管、酒精灯、烧杯外,还需要 .
Ⅱ:检验样品中是否含有CuO
方案1:将制得的Cu2O样品溶于足量稀硫酸.
(3)甲同学认为若溶液变为蓝色,则说明样品中含有CuO杂质.乙同学认为此推论不合理,用化学用语解释原因 .
(4)甲同学通过反思,认为将定性检验改为定量测定便能确定样品中是否含有CuO杂质,应测量的数据是 .
方案2:丙同学认为采用如下装置(所加药品均足量)进行实验,通过测定c装置反应后固体的质量以及d装置反应前后增重的质量,可计算,从而确定样品中是否含有氧化铜.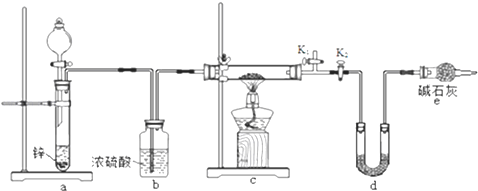
(5)装置a中所加的酸是(填化学式),装置e中碱石灰的作用是 .
(6)点燃装置c中酒精灯之前需进行的操作是 .
(7)熄灭酒精灯之后,仍需通一段时间H2至试管冷却,原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼氢化物NaBH4(B元素的化合价为+3价)燃料电池(DBFC),由于具有比能量高、产物清洁无污染和燃料易于储存和运输等优点,被认为是一种很有发展潜力的燃料电池,其工作原理如图所示,下列说法正确的是( )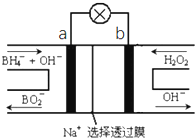
A.放电时,每转移2mol电子,理论上需要消耗9.5gNaBH4
B.电极a采用MnO2 , MnO2既作电极材料又有催化作用
C.电池放电时Na+从b极区移向a极区
D.电池的负极反应为BH4﹣+2H2O﹣8e﹣═BO2﹣+8H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)用于漂白织物、纤维、纸浆,具有对纤维损伤小的特点.其在溶液中可生成ClO2、HClO2、ClO2﹣、Cl﹣等,其中HClO2和ClO2都具有漂白作用.已知pOH=﹣lgc(OH﹣),经测定25℃时各组分含量随pOH变化情况如图所示(Cl﹣没有画出),此温度下,下列分析错误的是( ) 
A.HClO2的电离平衡常数的数值Ka=10﹣6
B.亚氯酸钠在碱性条件下较稳定
C.pH=7时,溶液中含氯微粒的浓度大小为:c(HClO2)>c(ClO2﹣)>c( ClO2)>c( Cl﹣)
D.同浓度的HClO2溶液和NaClO2溶液等体积混合,则混合溶液中有c(HClO2)+2c(H+)=c(ClO2﹣)+2c(OH﹣)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com