

分析 (1)①由题目所给信息可知,温度过高,二氧化氯的水溶液有可能爆炸,应降低反应温度;
②常温下二氧化氯为黄绿色或橘黄色气体,性质非常不稳定,为防止在较高温度下发生爆炸,应用冷水吸收;
③根据氯酸钾和草酸的质量关系判断反应的过量问题,计算生成二氧化氯的质量;
(2)①用ClO2处理过的饮用水(pH为5.5~6.5),水样呈酸性,应选用酸式滴定管量取水样;
②碘与淀粉变蓝,用淀粉溶液作指示剂,反应中生成碘单质显示蓝色,反应后无碘单质,蓝色褪去;
③根据I-被氧化为I2,ClO2-还原为Cl-书写离子方程式;
④步骤1~4的目的是测定水样中ClO2的含量,其反应的化学方程式为:2ClO2+2KI═2KClO2+I2,2Na2S2O3+I2═Na2S4O6+2NaI,步骤4滴定达到终点,读取Na2S2O3溶液时俯视其它操作正确,读取标准溶液体积减小,测定结果偏低,溶液中用I-将溶液中的ClO2-还原为Cl-以测定其含量偏高;
解答 解:(1)①由题目所给信息可知,温度过高,二氧化氯的水溶液有可能爆炸,应降低反应温度,温度低于100℃的水浴加热,用温度计控制温度,
故答案为:使反应正常进行,并防止温度过高引起爆炸;
②二氧化氯易溶于水,则可用水吸收,为防止温度过高而爆炸,应在低温下吸收,则b符合,
故答案为:b;
③n(KClO3)=$\frac{12.25g}{122.5g/mol}$=0.1mol,n(H2C2O4)=$\frac{9g}{90g/mol}$=0.1mol,
根据方程式2KClO3+H2C2O4+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2ClO2↑+2CO2↑+2KHSO4+2H2O可知道,H2C2O4过量,用KClO3的量计算,
则生成的n(ClO2)=0.1mol,m(ClO2)=0.1mol×67.5g/mol=6.75g,
故答案为:6.75g;
(2)①根据题意水样pH为5.5~6.5,呈酸性,且25mL与所量取的体积接近,故用25mL酸式滴定管,
故答案为:25mL酸式滴定管;
②根据题意可知滴定过程中出现了碘单质,碘与淀粉变蓝,故选淀粉做指示剂.滴定到终点时,碘单质正好反应完,故滴定达到终点时溶液的颜色变化为溶液蓝色褪去,且30秒内不恢复蓝色,
故答案为:淀粉溶液;溶液蓝色褪去,且30秒内不恢复蓝色;
③步骤5的目的是用I-将溶液中的ClO2-还原为Cl-以测定其含量,则I-被氧化为I2,故该反应的离子方程式为ClO2-+4I-+4H+=Cl-+2I2+2H2O,
故答案为:ClO2-+4I-+4H+=Cl-+2I2+2H2O;
④若步骤4滴定达到终点,读取Na2S2O3溶液时俯视其它操作正确,则测得的ClO2的含量偏低,步骤5的目的是用I-将溶液中的ClO2-还原为Cl-以测定其含量ClO2-的含量偏高,
故答案为:偏低;偏高;
点评 本题将元素化合物知识与生产工艺结合起来,引导我们关注化学学科的应用性和实践性,我们要在“相关反应化学方程式书写、化学反应条件控制的原理”等方面,加强对元素化合物性质及其转化关系的理解和应用熟悉程度,提高对新信息的处理能力,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | c(H+)=1×10-7mol/L的溶液一定是酸性 | |
| B. | 标况时,水本身电离出的c(H+)=1×10-13的溶液,可能是0.1mol•L-1的盐酸或0.1mol•L-1的NaOH溶液 | |
| C. | BaSO4难溶于水,是强电解质 | |
| D. | NH3•H2O的水溶液导电,所以NH3是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
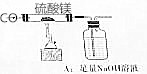 确定反应的化学方程式和制得的MgO的纯度,称量MgSO410.0g,放置于石英管中,按右图连接装置进行试验.试验步骤如下:
确定反应的化学方程式和制得的MgO的纯度,称量MgSO410.0g,放置于石英管中,按右图连接装置进行试验.试验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )| A. | 最简单气态氢化物的热稳定性:R>Q | |
| B. | 最高价氧化物对应水化物的酸性:Q<W | |
| C. | 原子半径:T>Q>R | |
| D. | 简单离子半径:T>R |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 $→_{H_{2}SO_{4}、丙酮、0℃}^{CrO_{3}}$B$→_{△}^{CH_{3}OH、H+}$
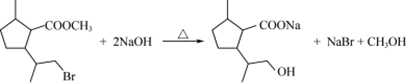
$→_{H_{2}SO_{4}、丙酮、0℃}^{CrO_{3}}$B$→_{△}^{CH_{3}OH、H+}$ $→_{过氧化物}^{HBr}$D$→_{②酸化}^{①NaOH溶液/△}$E$→_{△}^{浓H_{2}SO_{4}}$
$→_{过氧化物}^{HBr}$D$→_{②酸化}^{①NaOH溶液/△}$E$→_{△}^{浓H_{2}SO_{4}}$ 二氢荆芥内酯
二氢荆芥内酯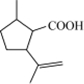 .
. .
. .
. 制备
制备 的合成路线图(无机试剂任选).合成路
的合成路线图(无机试剂任选).合成路查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某物质只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键).
某物质只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键).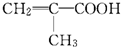 .
. $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$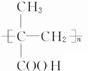 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
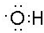 ;
;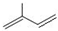 ;
;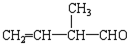 所含官能团的名称是碳碳双键、醛基;该有机物发生加聚反应后,所得产物的结构简式为
所含官能团的名称是碳碳双键、醛基;该有机物发生加聚反应后,所得产物的结构简式为 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com