
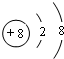 ,故答案为:
,故答案为: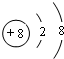 ;
;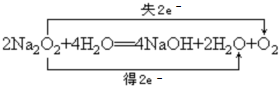 ,
, ;
;
| ||
| ||


科目:高中化学 来源: 题型:
A、 装置甲可用于检验有乙烯生成 装置甲可用于检验有乙烯生成 |
B、 装置乙可用于收集和吸收氨气 装置乙可用于收集和吸收氨气 |
C、 装置丙可用于除去Cl2中混有的HCl气体 装置丙可用于除去Cl2中混有的HCl气体 |
D、 装置丁可分离CH3COOC2H5和饱和碳酸钠溶液 装置丁可分离CH3COOC2H5和饱和碳酸钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
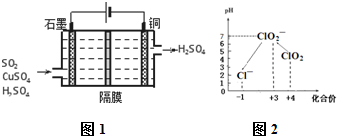
| 操作① |
| 加试剂A |
| 饱和Na2CO3溶液 |
| ① |
| 盐酸 |
| ② |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 3名同学在用氯酸钾和二氧化锰混合加热制取氧气的过程中,发现生成的气体有刺激性气味,针对这一“异常现象”进行了实验探究及分析.
3名同学在用氯酸钾和二氧化锰混合加热制取氧气的过程中,发现生成的气体有刺激性气味,针对这一“异常现象”进行了实验探究及分析.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com