
【题目】下列有关化学反应速率的说法中正确的是( )。
A.二氧化锰能加快所有化学反应的速率
B.用铁片和稀硫酸反应制取氢气时,改用铁片和浓硫酸可以加快产生氢气的速率
C.100 mL 2 mol·L-1的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率变小
D.对于任何反应,增大压强都可加快反应速率
 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z三种短周期元素分别处于不同的周期。已知X原子和Y原子最外层电子数相同,Z原子次外层只有两个电子,X和Z可以形成离子化合物X2Z,Y和Z可以形成共价化合物Y2Z。
(1)写出元素符号是X______、Y______、Z______;
(2)Y单质的电子式是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型陶瓷A1N可通过反应: A12O3+N2+3C![]() 2A1N+3CO合成。下列正确的是
2A1N+3CO合成。下列正确的是
A.上述反应中,N2是还原剂,A12O3是氧化剂
B.A1N中氮元素的化合价为+3
C.上述反应中,每生成1 mol A1N需转移3 mol电子
D.A1N的摩尔质量为41 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.1 mol·L-1 NaOH溶液450 mL和0.5 mol·L-1硫酸溶液500mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是①__________(填序号),配制上述溶液还需用到的玻璃仪器是②____________(填仪器名称)。
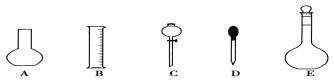
(2)根据计算用托盘天平称取NaOH的质量为③ g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度④__________0.1 mol·L-1(填“大于”、“等于”或“小于”)。
(3)由计算知,所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为__⑤__mL(计算结果保留一位小数)。如果实验室有15 mL、20 mL、50 mL量筒,应选用__⑥__mL量筒最好。配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是将浓硫酸沿烧杯壁缓缓倒入水中,并用玻璃棒不断搅拌。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、P、Q、W、R、T是元素周期表短周期中的常见主族元素,且原子序数依次增大,其相关信息如下表:
元素 | 相关信息 |
X | 其一种同位素,可被用作相对原子质量的标准 |
Y | 其最高价氧化物对应水化物能与其气态氢化物相互间发生化合反应 |
P | 是短周期中(除稀有气体外)原子半径最大的元素 |
Q | 存在质量数为25,中子数为13的核素 |
W | 位于周期表第13列 |
R | 与Z同族,且最高价氧化物对应水化物的浓溶液常温下与W单质会出现钝化现象 |
(1)R在元素周期表中的位置为 ;将Q、W、Z、Y的简单离子的半径从大到小排序___________________________________________(用离子符号表示)
(2)T的单质易溶于XT4中,理由是:____________________________________________。
(3)根据下表中信息,判断下列化合物固态的晶体类型(填“离子晶体”… 等):
化合物 | X3Y4 | R2T2 |
晶体类型 | ||
熔点/℃ | >3600 | -76 |
(4)任意写出一个由Y、Z元素分别与氢元素形成的10电子粒子间相互反应的离子方程式:___________。
(5)在25℃、101 kPa下,已知13.5 g的W固体单质在Z2气体中完全燃烧后恢复至原状态,放热419 kJ,写出表示W单质燃烧热的热化学方程式 。
(6)化合物P2R溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构相似的物质P2R2,其溶液显黄色,则P2R2的电子式为 ,用化学方程式表示P2R溶液在空气中的变质过程 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是依据一定的分类标准,对某些物质与水反应情况进行分类的分类图。请根据你所学的知识,按要求填空: ,
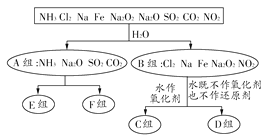
(1)上述第一级分类标准(分成A、B组所依据)是______。
(2)C组物质为______________(填化学式)。
(3)D组物质中,与水反应时氧化剂和还原剂的物质的量之比为1:1的物质是_________(填化学式)。
(4)若E组和F组均有两种物质,则其分类依据是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,某无色溶液能与铝反应放出氢气,该溶液中一定能大量存在的离子组是:( )
A. Na+、Cl-、K+、SO42- B.Mg2+、NH4+、SO42-、Cl-
C. Na+、K+、MnO4-、SO42- D.Na+、K+、CO32-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中p表示压强,T表示温度,n表示物质的量):

根据以上规律判断,下列结论正确的是( )
A.反应Ⅰ:ΔH>0,p2>p1
B.反应Ⅱ:ΔH>0,T1>T2
C.反应Ⅲ:ΔH>0,T2>T1;或ΔH<0,T2<T1
D.反应Ⅳ:ΔH<0,T2>T1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在a L Al2(SO4)3和(NH4)2SO4的混合溶液中加入b mol BaCl2,恰好使溶液中的SO完全沉淀;若加入足量强碱并加热可得到c mol NH3,则原溶液中的Al3+浓度(mol/L)为
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com