
【题目】将Na2O2粉末投入到下列稀溶液中,既有气体又有沉淀产生的是
A.NaHCO3B.FeCl3C.NaClD.HCl
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某课外活动小组设计的用化学电源使LED灯发光,装置如下。下列说法错误的是

A. 铜片表面有气泡生成
B. 装置中存在“化学能→电能→光能”的转换
C. 如果将硫酸换成NaOH溶液,LED灯也会发光
D. 如果将铝片换成银片,电路中的电流方向相反
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、R、T 的原子序数依次增大, X 的最外层电子数与次外层电子数相等, X、 W位于同族。Y和Z的价电子数之和等于R和T的最外层电子数之和,这四种元素组成两种盐Z2TY3和ZRY2。在含该两种盐的混合溶液中滴加盐酸,产生白色沉淀的物质的量与盐酸体积的关系如图所示。下列说法正确的是

A. 简单离子的半径:r(Y)<r(Z)<r(W)
B. 气态氢化物的热稳定性: T > Y
C. 工业上电解R的氯化物冶炼单质R
D. X的氢氧化物既可与强酸反应,又可与强碱反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O![]() Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
A.充电时阳极反应:Ni(OH)2 -e— + OH- = NiOOH + H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用物质的量浓度为0.100 0 mol·L-1的标准NaOH溶液去滴定V mL盐酸的物质的量浓度,请填写下列空白:

(1)用标准NaOH溶液滴定时,应将标准NaOH溶液注入_______(填“甲”或“乙”)中。
(2)某学生的操作步骤如下:
A.移取20.00 mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管使尖嘴部分充满溶液;
D.取标准NaOH溶液注入碱式滴定管至“0”刻度以上 2~3 mL;
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点并记下滴定管液面的刻度。
正确操作步骤的顺序是____→___→___→___→A→___(用字母序号填写)。判断到达滴定终点的实验现象是_____________________________________
(3)右上图是碱式滴定管中液面在滴定前后的读数, c(HCl)=_______ mol·L-1。
(4)由于错误操作,使得上述所测盐酸溶液的浓度偏高的是________(填字母)。
A.中和滴定达终点时俯视滴定管内液面读数
B.酸式滴定管用蒸馏水洗净后立即取用25.00 mL待测酸溶液注入锥形瓶进行滴定
C.碱式滴定管用蒸馏水洗净后立即装标准溶液来滴定
D.用酸式滴定管量取待测盐酸时,取液前有气泡,取液后无气泡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将AgNO3溶液分别滴加到浓度均为0.01mol/L的NaBr、Na2SeO3溶液中,所得的沉淀溶解平衡曲线如图所示(Br-、SeO32-用Xn-表示,不考虑SeO32-的水解)。下列叙述正确的是

A. Ksp(Ag2SeO3)的数量级为10-10
B. d点对应的AgBr溶液为不饱和溶液
C. 所用AgNO3溶液的浓度为10-3 mol/L
D. Ag2SeO3(s)+2Br-(aq)==2AgBr(s)+SeO32- (aq)平衡常数为109.6,反应趋于完全
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在室温下,相同体积、相同pH的氨水和NaOH溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是
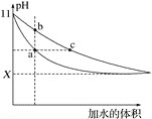
A. 处于a点溶液的导电能力比处于b点溶液的导电能力强
B. 对于b、c两点,氨水的电离常数Kb>Kc
C. 若取相同体积的处于a点和c点的溶液分别与同浓度的盐酸完全反应,消耗盐酸的体积Va<Vc
D. X的值接近7,但小于7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年报道了使用α-溴代羰基化合物合成大位阻醚和硫醚的有效方法,可用于药物化学和化学生物学领域。用此法合成化合物J的路线如下:

已知:
回答下列问题:
(1)A的结构简式为____________。D中含有的官能团名称是____________。
(2)由B生成C的化学方程式是______________________。
(3)C→D所需试剂和反应条件为_____________________。
(4)G的化学名称为_____________,F+H→J的反应类型是___________。
(5)F与C在CuBr和磷配体催化作用下也可合成大位阻醚,写出一种有机产物的结构简式:_____________。
(6)化合物X是E的同分异构体,分子中不含羧基,既能发生水解反应,又能与金属钠反应。符合上述条件的X的同分异构体有_____种(不考虑立体异构),其中能发生银镜反应,核磁共振氢谱有3组峰,峰面积之比为1:1:6的结构简式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国夏威夷联合天文中心的科学家发现了新的氢微粒,该微粒是由3个氢原子核(只含质子)和2个电子构成,关于这种微粒的下列说法中正确的是
A. 是氢元素的一种新的同素异形体
B. 是氢元素的一种新的同位素
C. 该微粒的组成可用H3表示
D. 该微粒比普通氢分子多一个氢原子核
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com