
【题目】能源的开发、利用与人类社会的可持续发展息息相关,充分利用好能源是摆在人类面前的重大课题。
Ⅰ.已知:①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH=a kJ·mol-1
②CO(g)+l/2O2(g)=CO2(g) ΔH=b kJ·mol-1
③C(石墨)+O2(g)=CO2(g) ΔH=c kJ·mol-1
则反应4Fe(s)+3O2(g)=2Fe2O3(s)的焓变ΔH=______________kJ·mol-1。
Ⅱ.依据原电池的构成原理,下列化学反应在理论上可以设计成原电池的是_____(填序号)。
C(s)+CO2(g)=2CO(g) ΔH>0
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH<0
C.2H2O(l)=2H2(g)+O2(g) ΔH>0
D.CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH<0
若以稀硫酸为电解质溶液,则该原电池的正极反应式为______________________。
Ⅲ.金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,充分燃烧时生成二氧化碳,反应中放出的热量如下图所示。

①在通常状况下,金刚石和石墨中________(填“金刚石”或“石墨”)更稳定,石墨的燃烧热为________。
②12 g石墨在一定量空气中燃烧,生成气体36 g,该过程放出的热量________。
【答案】 6c-6b-2a D O2+4H++4e-=2H2O 石墨 393.5 kJ·mol-1 252.0 kJ
【解析】Ⅰ.已知:①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH=a kJ·mol-1; ②CO(g)+l/2O2(g)=CO2(g) ΔH=b kJ·mol-1 ; ③C(石墨)+O2(g)=CO2(g) ΔH=c kJ·mol-1;根据盖斯定律,由③×6-②×6-①×2可得反应4Fe(s)+3O2(g)=2Fe2O3(s),则ΔH=6c-6b-2akJ·mol-1;
Ⅱ.设计成原电池需要是自发进行的氧化还原反应;A.C(s)+CO2(g)=2CO(g)是非自发进行的氧化还原反应,故A不选;B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l),反应是复分解反应,不是氧化还原反应,故B不选;
C.2H2O(l)=2H2(g)+O2(g),反应是非自发进行的氧化还原反应,故c不选;D.CH4(g)+2O2(g)=CO2(g)+2H2O(l),是自发进行的氧化还原反应,可以设计成原电池;故D选;答案为D;D反应是甲烷燃料电池,在酸溶液中甲烷燃料电池中燃料在负极发生氧化反应,氧气在正极得到电子发生还原反应,正极电极反应为O2+4H++4e-=2H2O;
Ⅲ.(1)图象分析金刚石能量高于石墨,能量越低越稳定,所以说明石墨稳定,图象分析1mol石墨完全燃烧生成1mol二氧化碳放出的热量为393.5kJ,则石墨的燃烧热为393.5kJmol-1;
(2)12g石墨物质的量为1mol,在一定量空气中燃烧,依据元素守恒,若生成二氧化碳质量为44g,若生成一氧化碳质量为28g,生成气体36g,28g<36g<44g,判断生成的气体为一氧化碳和二氧化碳气体,设一氧化碳物质的量为x,二氧化碳物质的量为(1-x)mol,28x+44(1-x)=36g,x=0.5mol,二氧化碳物质的量为0.5mol;依据图象分析,C(石墨,s)+O2(g)═CO2(g)△H=-393.5 kJmol-1 ;C(石墨,s)+ ![]() O2(g)═CO(g)△H=-110.5 kJmol-1 ,生成二氧化碳和一氧化碳混合气体放出热量=393.5 kJmol-1 ×0.5mol+110.5 kJmol-1 ×0.5mol=252KJ;12g石墨在一定量空气中燃烧,生成气体36g,该过程放出的热量为252.0kJ。
O2(g)═CO(g)△H=-110.5 kJmol-1 ,生成二氧化碳和一氧化碳混合气体放出热量=393.5 kJmol-1 ×0.5mol+110.5 kJmol-1 ×0.5mol=252KJ;12g石墨在一定量空气中燃烧,生成气体36g,该过程放出的热量为252.0kJ。


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:
【题目】下列事实与胶体性质无关的是( )
A. 长江入海口形成三角洲
B. 向豆浆中加入盐卤做豆腐
C. 将植物油倒入水中用力搅拌形成油水混合物
D. 一束平行光射入蛋白质溶液里,从侧面可以看到一束光亮的通路
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,恒容的密闭容器中存在反应:2A(g)+B(s) ![]() 2C(g) △H<0。下列描述中能证明上述反应已达平衡状态的是
2C(g) △H<0。下列描述中能证明上述反应已达平衡状态的是
A.摩尔质量:A<C
B.容器中混合气体的密度不随时间而变化
C容器中的气体压强不随时间而变化
D.容器中A与C的物质的量之比等于1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验报告中记录了下列数据,其中正确的是( )
A. 用25 mL量筒量取12.36 mL盐酸
B. 用pH试纸测出某溶液pH为3.5
C. 用托盘天平称取8.75 g食盐
D. 用酸式滴定管测出消耗盐酸的体积为15.60 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池的工作原理为:Pb+PbO2+2H2SO4===2PbSO4+2H2O,研读下图,下列判断不正确的是

A.K闭合时,d电极反应式:PbSO4+2H2O-2e-===PbO2+4H++SO42-
B.当电路中转移0.2 mol电子时,Ⅰ中消耗的H2SO4为 0.2 mol
C.K闭合时,Ⅱ中SO42-向c电极迁移
D.K闭合一段时间后,Ⅱ可单独作为原电池,d电极为正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种元素,它们均为短周期元素。已知A是非金属性最强的元素,且E与A同族;金属B的原子核内质子数比前一周期的同族元素多8,其单质不能从CuSO4溶液中置换出Cu;C元素有三种同位素,Cl、C2、C3,C1的质量数分别为C2、C3的1/2和1/3;D的气态氢化物溶于水后显碱性。
(1)写出B元素的离子结构示意图 ;C2粒子的符号: ;
(2)B、E两种元素形成化合物的电子式:
(3)A、E两种元素形成的氢化物沸点较高的是: (用化学式表示),其原
因是 。
(4)写出D的气态氢化物与其最高价氧化物的水化物反应的离子方程式
(5)写出D的氢化物(过量)与E的单质发生氧化还原反应生成一种单质和一种盐的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A,B是短周期元素,两元素能形成B2A型离子化合物,B离子比A离子少一个电子层,已知A的原子序数为n,则B的原子序数为( )
A.n﹣5
B.n+3
C.n+13
D.n﹣13
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物C是一种合成药品的中间体,其合成路线为:
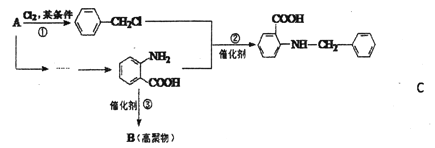
已知:
(1)写出![]() 中宮能团的名称_____________。
中宮能团的名称_____________。
(2)写出反应①的化学方程式_________________。
(3)反成②属于_______反应(填有机反应类型)。
(4)D是比![]() 多一个碳的同系物,则满足下列条件的D的间分异构体共有______种,写出一种满足条件且含4种不同氢原+的同分异构体的结构简式 __________。
多一个碳的同系物,则满足下列条件的D的间分异构体共有______种,写出一种满足条件且含4种不同氢原+的同分异构体的结构简式 __________。
①显弱碱性,易被氧化 ②分子内含有苯环 ③能发生水解反应
(5)请你设计由A合成B的合成路线。 __________
提示:①合成过程中无机试剂任选;②合成路线表示方法示例如下:
![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com