
【题目】铜-锌原电池如图所示,电解质溶液为硫酸铜溶液,电池工作一段时间后,下列说法不正确的是( )
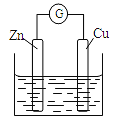
A. 锌电极上的反应为Zn-2e-=Zn2+
B. 溶液中的硫酸根向锌电极移动
C. 铜电极质量增加
D. 电流从锌电极经过金属导线流向铜电极
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】固体化合物X由四种常见的元素组成,为探究其成分,某学生进行如下实验:
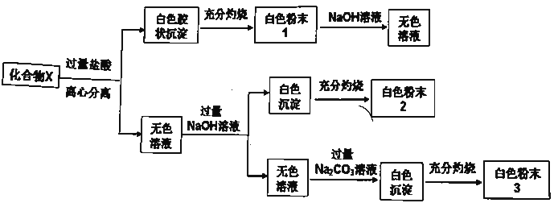
①20.8gX固体进行实验,得到白色粉末1质量12.0g,白色粉末2质量为6.0g;
②白色粉末2可用作耐高温材料,白色粉末3是一种常见干燥剂;请回答问题:
(1)X中金属元素的名称是______。
(2)化合物X与足量盐酸反应离子方程式______。
(3)在高温条件下,白色粉末2中某元素单质与白色粉末1反应,是工业制备另一种单质方法之一,写出该反应的化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为1.00 mol/L、2.00 mol/L,大理石有细颗粒和粗颗粒两种规格,实验温度为25℃、35℃,每次实验HNO3的用量为25.00 mL,大理石用量为10.00 g。
(1)请完成以下实验设计表,并在实验目的一栏中填空:
实验编号 | 温度(℃) | 大理石规格 | HNO3浓度(mol/L) | 实验目的 |
① | 25 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究浓度对反应速率的影响;(Ⅱ)实验①和③探究温度对反应速率的影响;(Ⅲ)实验①和④探究________对反应速率的影响 |
② | 25 | 粗颗粒 | _______ | |
③ | _______ | 粗颗粒 | 2.00 | |
④ | _________ | 细颗粒 | ______ |
(2)实验①中CO2质量随时间变化的关系见下图。计算实验①中70 s~90 s范围内用HNO3表示的平均反应速率________(忽略溶液体积变化,不需要写出计算过程)。在O~70、70~90、90~200各相同的时间段里,反应速率最大的时间段是________。
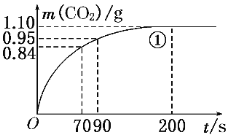
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烃A是一种重要的化工原料,己知气体A在标准状况下相对氢气的密度为13,B可发生银镜反应,它们之间的转化关系如右图。请回答:

(1)有机物C中含有的官能团名称是________,反应③的反应类型是____________。
(2)反应①的原子利用率达100%,该反应的化学方程式是______________________。
(3)下列说法正确的是__________________。
A.反应④也能实现原子利用率100%
B.乙酸乙酯在氢氧化钠溶液中水解的反应叫作皂化反应
C.有机物A、B、C均能使酸性高锰酸钾溶液褪色
D.有机物B和D都可以与新制碱性氢氧化铜悬浊液发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌与浓硫酸反应,随着硫酸的浓度下降,产生的气体中混有H2,为证实相关分析,化学小组的同学设计了如图所示的实验装置,对反应后的气体(X)取样进行组分分析(遇有气体吸收过程,视为完全吸收)。
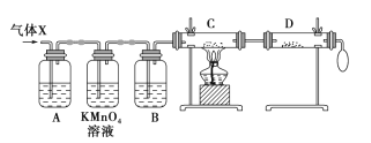
(1)A中加入的试剂可能是_________,若高锰酸钾溶液与B 之间不再添加装置,请描述观察到何种现象能表明已达到使用高锰酸钾溶液的目的_______________。
(2)可证实气体 X 中混有较多氢气的实验现象是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质A-F是我们熟悉的单质或化合物,其中A、B均是常见的金属,且B的合金用量最大;E在常温下是黄绿色气体;适当的条件下,它们之间可以发生如图所示的转化。
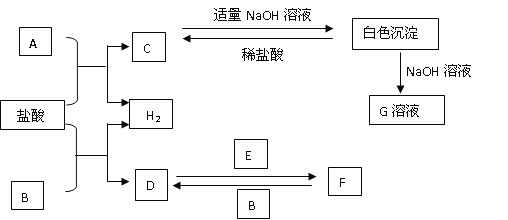
(1)A的原子结构示意图___;G溶液中溶质的化学式为___。
(2)请写出反应D→F的化学方程式:___。
(3)检验F中金属阳离子的常用试剂是___(填物质的化学式);现象是___。
(4)E物质可与石灰乳反应制取漂白粉,写出漂白粉的有效成分___。
(5)写出C与足量氢氧化钠溶液反应的离子方程式___。
(6)FeCl3溶液和氢氧化铁胶体的本质区别是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ⅰ)如图为一“铁链”图案,小明在图案上分别写了H2、CO2、Na2O、NaCl、FeCl3五种物质,图中相连的两种物质均可归属为一类,相交部分A、B、C、D为其相应的分类依据代号。请回答下列问题:
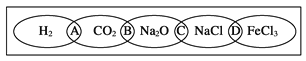
(1)请将分类依据代号填入相应的括号内:
(_______________)两种物质都不是电解质
(________________)两种物质都是盐
(2)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入饱和的图中某种物质M的溶液加热至呈红褐色。
①物质M的化学式为________________。
②证明有红褐色胶体生成的实验操作是____。
(Ⅱ)反应:
A.2F2+2H2O=4HF+O2↑; B.2Na+2H2O=2NaOH+H2↑;
C.CaO+H2O=Ca(OH)2; D.2H2O=2H2↑+O2↑。
其中水只是氧化剂的是______(填序号),反应B中被氧化的元素名称是________。
(Ⅲ)反应:3Cu + 8HNO3 = 3Cu(NO3)2+2NO↑+4H2O, 硝酸在该反应中的作用是______ 还原剂与氧化剂的物质的量之比:__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式或电离方程式书写正确的是( )
A.铁与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑
B.硝酸银溶液中加入铁粉:Ag++Fe=Fe2++Ag
C.硫酸氢钠的电离方程式:NaHSO4=Na+ + H+ + SO42-
D.碳酸氢钠的电离方程式:NaHCO3=Na+ + H++ CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种元素,其中A、B、C属于同一周期,A原子最外层p能级的电子数等于次外层的电子总数。B元素可分别与A、C、D、E生成RB2型化合物,并知在DB2和EB2中,D与B的质量比为7:8,E与B的质量比为1:1。根据以上条件,回答下列问题:
(1)推断C、D、E元素分别是(用元素符号回答):C____,D___,E___。
(2)写出D原子的电子排布式____。
(3)写出A元素在B中完全燃烧的化学方程式_____。
(4)指出E元素在元素周期表中的位置____。
(5)比较A、B、C三种元素的第一电离能的大小顺序___(按由大到小的顺序排列,用元素符号表示)。
(6)比较元素D和E的电负性的相对大小___。(按由大到小的顺序排列,用元素符号表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com