
【题目】现有前四周期A,B,C,D,E、X六种元素,已知B,C,D,E、A五种非金属元素原子半径依次减小,其中B的s能级上电子总数等于p能级上电子总数的2倍.X原子的M能层上有4个未成对电子.请回答下列问题:
(1)写出C,D,E三种原子第一电离能由大到小的顺序为__。
(2)A原子与B,C,D原子形成最简单化合物的稳定性由强到弱的顺序为__,根据价层电子对互斥理论预测BA2D的分子构型为__。
(3)某蓝色晶体,其结构特点是X2+、X3+离子分别占据立方体互不相邻的顶点,而立方体的每条棱上均有一个BC﹣.与A同族且相差两个周期的元素R的离子位于立方体的恰当位置上,根据其结构特点可知该晶体的化学式为____(用最简正整数表示)。
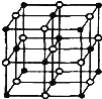
(4)科学家通过X射线探明,KCl、MgO、CaO、TiN的晶体结构与NaCl的晶体结构相似(如右图所示),其中3种离子晶体的晶格能数据如下表:

根据表格中的数据:判断KCl、MgO、TiN 三种离子晶体熔点从高到低的顺序是__,MgO晶体中一个Mg2+周围和它最邻近且等距离的O2﹣有__个。
(5)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好,离子型氧化物V2O5和Cr2O3中,适合作录音带磁粉原料的是__。
【答案】F>N>O H2O>NH3>CH4 平面三角形 NaFe2(CN)6 TiN>MgO>KCl 6 Cr2O3
【解析】
根据B的s能级上电子总数等于p能级上电子总数的2倍,则电子排布式为:1s22s22p2,故为C,B、C、D、E、A五种非金属元素原子半径依次减小,则为同周期,故B为C,C为O,D为F,A为H。
(1)同周期从左到右第一电离能依次增大,但是在第ⅤA族的氮原子,p轨道上半充满状态稳定,不易失去电子,故答案为:F>N>O;
(2)C、N、O原子的得电子能力O>N>C,得电子能力越强,其氢化物的稳定性越强,根据价层电子对互斥理论,CH2O的中心原子的杂化方式为sp2杂化,为平面三角形,故答案为:H2O>NH3>CH4;平面三角形;
(3)X原子的M能层上有4个未成对电子,则电子排布式为:1s22s22p63s23p63d64s2,故为Fe,BC-为CN-,与A同族且相差两个周期的元素R即为Na,根据立方体结构,每个晶胞中含有钠、铁、和氢氰根的个数为:1、2、6,分子式为:NaFe2(CN)6,故答案为:NaFe2(CN)6;
(4)因为KCl、MgO、TiN的晶体结构与NaCl的晶体结构相似,离子半径越小、离子电荷越多则晶体的晶格能越大,晶格能越大则晶体熔点越高,故熔点从大到小的顺序为TiN>MgO>KCl。MgO晶体与氯化钠相似,故一个Mg2+周围和它最邻近且等距离的O2-有6个,答案为:TiN>MgO>KCl;6;
(5)金属铬(+3)离子和钒(+5)离子的未成对电子数分别为3和0,则三氧化二铬磁性大、磁记录性能好,适合作磁粉材料,故答案为:Cr2O3。


 灵星计算小达人系列答案
灵星计算小达人系列答案科目:高中化学 来源: 题型:
【题目】材料的不断发展可以促进社会进步:
(1)玻璃是常见的硅酸盐产品,制玻璃发生的主要反应为_________,__________。
(2)钢化玻璃是一种常见的玻璃产品,其主要成分为_______________。
我们看到的玻璃,一般都呈淡绿色,只是因为原料中混有____________。
(3)插座也是一种塑料,它有绝缘性好,耐热,抗水等优点。它属于热____性塑料。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维生素C的结构简式如图所示:

⑴维生素C分子中—OH原子团的名称是__________________;维生素C__________________溶于水(填“易”或“难”),属于________________ 维生素(填“脂溶性”或“水溶性”)。
⑵维生素C又被称为抗坏血酸,它能促进胶原蛋白形成,所以能防治_____________
⑶一个人每天摄入约100mg维生素C就能满足需要,下列物质中含有丰富维生素C的是____
A.苦瓜 B.鸡蛋 C.豆腐 D.沙丁鱼
⑷“服用维生素C,可使食物中的三价铁离子还原成二价铁离子”这句话说明:维生素C具有_____________性(填“氧化性”或“还原性”);维生素C在这一反应中发生了_____________(填“氧化反应”或“还原反应”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】富硒食品倍受追捧是因为硒(Se)被誉为“生命的奇效元素”。硒与氧同主族,与钙同周期。下列关于硒的描述错误的是
A.原子序数为34B.氢化物的稳定性:H2Se>H2S.
C.原子半径:Ca>SeD.最高价含氧酸的酸性:H2SeO4<H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿司匹林是一种常用的治感冒药,其结构简式如图所示,下列有关阿司匹林的说法正确的是

A. 1mol阿司匹林最多能与5mol H2反应
B. 1mol阿司匹林最多能与1molNaHCO3反应
C. 1mol阿司匹林最多能与2mol NaOH反应
D. 1mol阿司匹林与足量的Na反应生成ImolH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A,B,C,D是四种短周期元素,E是过渡元素。A,B,C同周期,C,D同主族,A的原子结构示意图为 ,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2。试回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2。试回答下列问题:
(1)写出下列元素的符号:A__________,B__________,C__________,D__________。
(2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是________,碱性最强的是__________。
(3)用元素符号表示D所在周期第一电离能最大的元素是________,电负性最大的元素是__________。
(4)E元素原子的核电荷数是__________,E元素在周期表的第________周期第________族,已知元素周期表可按电子排布分为s区、p区等,则E元素在________区。
(5)写出D元素原子构成单质的电子式__________,该分子中有____个σ键,____个π键。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置或操作合理的是

A. 装置①可用于证明溴乙烷、NaOH、乙醇溶液共热生成乙烯
B. 装置②可用于实验室制取少量乙烯
C. 装置③可用于制备少量的乙酸乙酯
D. 装置④可用于比较碳酸与苯酚的酸性强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室研究不同价态元素的转化,对于物质的制备和应用至关重要。
(1)实验室可以用如右图所示装置研究S(+6)→S(+4)。

①装置C的作用是___________;
②B、D盛放的试剂分别应为___________、___________(填字母标号)
a.BaCl2溶液
b.KI淀粉溶液
c.FeSO4溶液
d.NaOH溶液
e.品红
③实验结束后,发现A中溶液几乎为无色,且试管中有较多的白色固体。试管中溶液显无色,体现了浓硫酸的___________性质;
④实验结束后,若要证明A中白色固体为CuSO4,需要采取的操作是___________。
(2)硫代硫酸钠(Na2S2O3)是用途广泛的化工产品。某同学欲探究其能否用做脱氯剂(除去游离氯),设计如图所示的实验。

已知:S2O32-+2H+=S↓+SO2↑+H2O
①烧瓶中发生反应的化学方程式为___________;
②若要判断Na2S2O3能否做脱氯剂,该同学还需要进行的实验是___________;
③I2标准溶液是测定硫代硫酸钠纯度的重要试剂,其浓度可以通过基准物质As2O3来标定:称取a g As2O3置于锥形瓶中,加人适量NaOH恰好将As2O3转化成Na3AsO3,加入淀粉溶液做指示剂,再用I2溶液进行滴定,消耗I2标准溶液体积为v mL。
i.滴定反应(产物之一是AsO43-)的离子方程式为______________________;
ii.I2标准溶液的物质的量浓度为___________。(用含a、v的代数式表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com