
【题目】用下列实验装置进行相应实验,能达到实验目的且操作正确的是( )
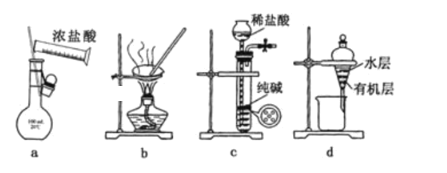
A.用图a所示装置配制l00mL0.100mo1L-1稀盐酸
B.用图b所示装置蒸发NaCl溶液制备NaCl固体
C.用图c所示装置制取少量CO2气体
D.用图d所示装置分离用苯萃取碘水后已分层的有机层和水层
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源: 题型:
【题目】(1)已知下列反应:Fe + S == FeS 2Fe + 3Cl2 ==2FeCl3 3Fe + 2O2 ==Fe3O4 则 S,Cl2,O2 的氧化性:______>_____ >______
(2)用双线桥标出下列反应中电子转移的方向和数目:______
MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
该反应中的氧化剂是________,HCl体现的性质是_______________,若有4molHCl参加反应,则被氧化的HCl的物质的量是______mol,如反应中转移了0.4mol电子,则产生的Cl2在标准状况下体积为_________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铁是一种重要的无机材料,化学性质稳定,催化活性高,具有良好的耐光性、耐热性和对紫外线的屏蔽性,从某种工业酸性废液(主要含Na+、Fe2+、Fe3+、Mg2+、Al3+、Cl-、SO42-)中回收氧化铁流程如下:

已知:常温下Ksp[Mg(OH)2]=1.2×10-11;Ksp[Fe(OH)2]=2.2×10-16;Ksp[Fe(OH)3]=3.5×10-38;Ksp[Al(OH)3]=1.0×10-33
(1)写出在该酸性废液中通入空气时发生的离子反应方程式:___________,指出使用空气的优点是:_________。
(2)已知Fe3+(aq)+3OH-(aq)===Fe(OH)3(s)ΔH=-Q1kJ·mol-1,题(1)中每生成1 mol含铁微粒时,放热Q2,请你计算1 mol Fe2+全部转化为Fe(OH)3(s)的热效应ΔH=_________。
(3)常温下,根据已知条件计算在pH=5的溶液中,理论上下列微粒在该溶液中可存在的最大浓度c(Fe3+)=___________,c(Mg2+)=___________。
(4)有人用氨水调节溶液pH,在pH=5时将Fe(OH)3沉淀出来,此时Fe(OH)3沉淀中可能混有的杂质是______ (填化学式,下同),用_______试剂可将其除去。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化钠(NaCl)是生活中常用的化学品,也是重要的化工生产原料。
(1)某同学用含钠元素的不同类别物质制备NaCl。请再列举3种反应:
①2Na+Cl2![]() 2NaCl
2NaCl
②___;
③___;
④___。
(2)粗盐中一般含有CaCl2、MgCl2、CaSO4和MgSO4杂质。从粗盐制得精盐的过程如下:

①写出MgCl2、CaSO4的电离方程式:___、___。
②各操作分别是:操作a___、操作b___、操作c___。
③试剂Ⅰ是___。
④加入试剂Ⅱ所发生的离子方程式为___,加入试剂Ⅲ所发生的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】湖南大学研制的一种铝离子电池充放电7500次后容量几乎没有衰减,预测20年后该电池依然使用如初。其放电时的有关转化如图所示。下列说法中正确的是( )

A. 放电时,Li+向负极移动
B. 放电时,电路中每流过3mol电子,正极的质量减少27g
C. 充电时,阴极的电极反应式为4Al2Cl7- +3e-=7AlCl4- +Al
D. 充电时,MnO2极与外电源的负极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有室温下四种溶液,有关叙述不正确的是
序号 | ① | ② | ③ | ④ |
pH | 11 | 11 | 3 | 3 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
A. ③④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大
B. ②③两溶液等体积混合,所得溶液中c(H+)>c(OH-)
C. 分别加水稀释10倍,四种溶液的pH①>②>④>③
D. V1L④与V2L①溶液混合后,若混合后溶液pH=7,则V1<V2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室配制500mL0.1mol/LNa2CO3,溶液回答下列问题
(1)配制Na2CO3溶液时需用的主要仪器有托盘天平、滤纸、烧杯、药匙、量筒、___、___、___。
(2)配制溶液过程如下:
A.用托盘天平称取Na2CO3·10H2O晶体___g;
B.将固体置于烧杯中,用量筒向其中加水溶解,并恢复至室温;
C.用玻璃棒引流,将溶液转移至容量瓶;
D.洗涤玻璃棒和烧杯2-3次,将洗涤液都转移入容量瓶中;
E.___;
F.继续向容量瓶中注水,至液面离容量瓶颈刻度线下___cm时,改用___滴加蒸馏水至液面与刻度线相切;
G.盖好瓶塞,用食指抵住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次摇匀;
H.将溶液转移至试剂瓶中,贴上标签,标注试剂名称、浓度及配制时间。
(3)若实验遇下列情况,溶液的浓度是偏高,偏低还是不变?
A.加水时超过刻度线___;
B.溶解后未冷却到室温就转入容量瓶___;
C.容量瓶内壁附有水珠而未干燥处理___;
D.定容时仰视___;
E.上下颠倒摇匀后液面低于刻度线___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,按下列物质的量关系进行反应,其对应的离子方程式或化学方程式书写正确的是
A.n(Cl2)∶n(Fe)=5∶4;5Cl2+4Fe![]() 2FeCl2+2FeCl3
2FeCl2+2FeCl3
B.n(Cl2)∶n(FeBr2)=1∶1;Fe2++2Br+Cl2=Fe3++Br2+2Cl
C.n(MnO4-)∶n(H2O2)=2∶3;2MnO4-+3H2O2+6H+=2Mn2++4O2↑+6H2O
D.n(Fe) ∶n[HNO3(稀)]=1∶3;4Fe+12H++3NO3-=3Fe2++Fe3++3NO↑+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,正确的是
A. H2SO4的摩尔质量是98
B. 等质量的O2和O3中所含的氧原子数相同
C. 等质量的CO与CO2中所含碳原子数之比为7︰11
D. 98g H2SO4溶解于500mL水中,所得溶液中硫酸的物质的量浓度为2 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com