
【题目】一种利用废干电池中黑色粉末(主要成分MnO2、炭粉及少量Hg2+、Pb2+等重金属盐)制备MnSO4晶体的工艺流程如图:
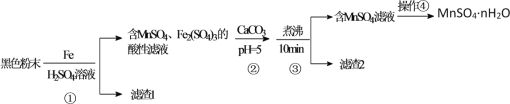
下列说法错误的是( )
A.反应①中1molFe至多还原1.5molMnO2
B.重金属主要在滤渣2中
C.步骤③煮沸可使沉淀颗粒长大,目的是便于固液分离
D.合理处理废旧电池有利于资源再利用并防止汞、铅等重金属污染
【答案】B
【解析】
黑色粉末(主要成分MnO2、炭粉及少量Hg2+、Pb2+等重金属盐)用浓硫酸溶解,并加入适量铁粉,过滤后所得滤渣1中主要是不溶于水的炭粉、和置换出的Hg、Pb等,滤液中主要含有MnSO4、Fe2(SO4)3,加入CaCO3并调节溶液pH=5左右,并加热煮沸,促进Fe3+水解生成Fe(OH)3,则过滤后滤渣2主要为Fe(OH)3,滤液主要含有MnSO4,滤液经蒸发浓缩并冷却结晶、过滤即可得到MnSO4nH2O;
A.用Fe和浓H2SO4溶解MnO2时发生反应的化学方程式为2Fe+3MnO2+6H2SO4=3MnSO4+Fe2(SO4)3+6H2O,反应中1molFe参加反应,被还原的MnO2是1.5mol,故A正确;
B.步骤①中同时发生Fe+Hg2+=Fe2++Hg、Fe+Pb2+=Fe2++Pb,则重金属Hg、Pb主要在滤渣1中,故B错误;
C.悬浊液中Fe(OH)3颗粒越大,越易与MnSO4溶液过滤分离,则步骤③煮沸使Fe(OH)3沉淀颗粒长大,目的是便于固液分离,故C正确;
D.锰等是重要金属资源,汞、铅等重金属能来得污染环境,则合理处理废旧电池有利于资源再利用并防止汞、铅等重金属污染,故D正确;
故答案为B。


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】以苯为原料可以合成有关产品,其流程如图:
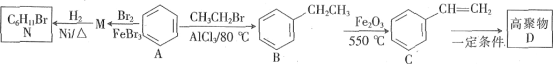
回答下列问题:
(1)B的名称是____。
(2)1个C分子最多有___个原子共平面。
(3)A→M的反应类型是___;C中官能团名称是___。
(4)写出M→N的化学方程式:____。
(5)N的一氯代物有____种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有的离子可能是K+、Ba2+、Al3+、Mg2+、A1O2-、CO32-、SiO32-、Cl-中的几种,现进行如下实验:
①取少量溶液加氢氧化钠溶液过程中无沉淀生成;
②另取少量原溶液,逐滴加入5 mL 0.2 mol L-1的盐酸,发生的现象是开始产生沉淀并逐渐增多,沉淀量基本不变后产生气体,最后沉淀逐渐减少至消失;
③在上述②沉淀消失后的溶液中,再加入足量的硝酸银溶液可得到沉淀0.435 g。
下列说法中正确的是
A.该溶液中一定不含有Ba2+、Mg2+、Al3+、SiO32-、Cl-
B.该溶液中一定含有K+、AlO2-、CO32-、Cl-
C.该溶液中是否含有K+需做焰色反应(透过蓝色钴玻璃片)
D.可能含有Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据分子的空间结构判断原子共线和共面问题、判断物质的性质和同分异构体是学习有机化学所必须具备的基本能力。请解答以下问题:
(1)下列反应的产物中,有的有同分异构体,有的没有同分异构体,其中一定不存在同分异构体的反应是______。
A 异戊二烯(![]() )与等物质的量的Br2发生加成反应
)与等物质的量的Br2发生加成反应
B 邻羟基苯甲酸与NaHCO3溶液反应
C 2氯丁烷与NaOH乙醇溶液共热发生消去HCl分子的反应
D 甲苯在一定条件下发生硝化反应生成一硝基甲苯的反应
E 丙烷与溴蒸汽在光照下发生一取代反应
F 甲酸乙酯在稀硫酸作用下加热水解
(2)某烃结构简式如下:![]() ,有关其结构说法正确的是(_______)
,有关其结构说法正确的是(_______)
A 所有原子可能在同一平面上 B 所有原子可能在同一条直线上
C 所有氢原子可能在同一平面上 D 所有碳原子可能在同一平面上
(3)有机物A是一种广谱高效食品防腐剂,如图所示是A分子的球棍模型。回答下列问题:
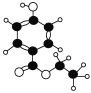
(Ⅰ)写出A的分子式:_______;
(Ⅱ)A能够发生反应的类型有(填序号):_________;
①氧化反应 ②加成反应 ③取代反应 ④消去反应
(Ⅲ)写出A与烧碱溶液反应的化学方程式:___________。
(4)下列是一些中草药中所含的有机物:
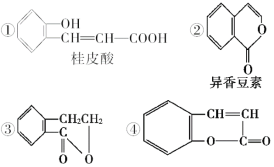
其中互为同分异构体的是(填序号)______;能与溴水反应的是(填序号)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A.将![]() 通入酸性高锰酸钾溶液,溶液褪色,体现
通入酸性高锰酸钾溶液,溶液褪色,体现![]() 的还原性
的还原性
B.浓硫酸滴在白纸上,白纸变黑,体现了浓硫酸的吸水性
C.硅晶体具有半导体性能,可用于制造光导纤维
D.将![]() 为5.4的雨水样品在空气中放置一段时间后,测得
为5.4的雨水样品在空气中放置一段时间后,测得![]() 变小,是因为样品吸收了空气中的
变小,是因为样品吸收了空气中的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 25 ℃时0.1molL﹣1NH4Cl溶液的Kw大于100℃时0.01molL﹣1NaCl溶液的Kw
B. 常温下,pH均为3的醋酸和硫酸铝两种溶液中,由水电离出的氢离子浓度之比为1∶108
C. 根据溶液的pH与酸碱性的关系,推出pH=6.5的溶液一定显酸性
D. 室温下,将pH=2的盐酸与pH=12的氨水等体积混合,溶液显中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下二氯化二硫(S2 Cl2)为红棕色液体,其结构式为Cl-S-S-Cl。其制备反应及与水反应的化学方程式如下:①CS2+3Cl2 ![]() CCl4+S2Cl2 ②2S2Cl2 +2H2O=4HCl+SO2↑+3S↓则下列说法正确的是 ( )
CCl4+S2Cl2 ②2S2Cl2 +2H2O=4HCl+SO2↑+3S↓则下列说法正确的是 ( )
A. 反应①中CS2作氧化剂
B. 反应②中S2Cl2既作氧化剂又作还原剂
C. 反应①中每生成1mol S2Cl2转移4mol电子
D. 反应②中氧化产物与还原产物的物质的量之比为3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】⑴在①NaCl、②NaOH、③N2、④H2S、⑤Na2O2中,只含有离子键的是________,只含有极性键的是______,既含离子键又含非极性共价键的是____。
(2)写出下列物质的电子式:
CO2____________NaCl____________ HClO_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室模拟工业上以铝土矿(含Al2O3、Fe2O3、SiO2)为原料制铵明矾NH4Al(SO4)2晶体的工艺流程如图所示,下列说法错误的是( )
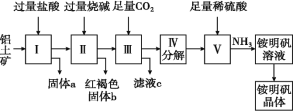
A.固体a的化学式为SiO2
B.固体b的化学式为Fe(OH)3
C.Ⅲ中通入足量CO2气体发生反应的离子方程式为2AlO2-+CO2+3H2O= CO32-+2Al(OH)3↓
D.由Ⅰ→Ⅱ→Ⅲ都要用到的分离方法是过滤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com