
����Ŀ���������⡿������̼��һ�ֱ����̼����Դ����CO2��NH3Ϊԭ�Ϻϳ������ǹ̶�������CO2
�ijɹ������������غϳ����е���Ҫ��Ӧ�ɱ�ʾ���£�
��Ӧ I��2NH3(g)+CO2(g) ![]() NH2COONH4(s) ��H1=-159.47 kJ��mol-1
NH2COONH4(s) ��H1=-159.47 kJ��mol-1
��ӦII��NH2COONH4(s) ![]() CO(NH2)2(s)+H2O(g) ��H2=+72.49kJ��mol-1
CO(NH2)2(s)+H2O(g) ��H2=+72.49kJ��mol-1
��ش��������⣺
(l)д��CO2��NH3Ϊԭ���������غ���̬ˮ���Ȼ�ѧ��Ӧ����ʽ_______,��ӦII�Է����е�������_____��
(2)CO2��NH3Ϊԭ�Ϻϳ����صķ�Ӧ��Ӱ��CO2ת���ʵ����غܶ࣬��ͼΪij���������£���ͬˮ̼��[n(H2O)/n(CO2)]���¶�Ӱ��CO2ת���ʱ仯���������ߡ�

����˵������ȷ����__________��
A.�¶����{�÷�Ӧƽ�ⳣ����С�����߲�������ƽ�����������ƶ�
B.���¶ȵ���190��,���¶����{CO2ת������������ԭ��������¶�����ƽ�����������ƶ�
C.���¶��{��190������¶����{CO2ת������С����ԭ��������¶����߷����˸���Ӧ
D.����������ͬʱ��Ϊ���{CO2��ת���ʣ������п��Բ�ȡ�Ĵ�ʩ�����ˮ̼��
(3)ij�о�С��Ϊ̽����ӦI��Ӱ��C(CO2)�����أ��ں����½�0.4molNH3��0.2molCO2�����ݻ�Ϊ2L���ܱ������У�t1ʱ�ﵽƽ�⣬��c(CO2)��ʱ��t�仯������������ͼ��ʾ�������淴Ӧ��ƽ�ⳣ��Ϊ_____���������������䣬t1ʱ���������ѹ����1L,�뻭��t1t2ʱ���C(CO2)��ʱ��t�仯�������ߣ�t2ʱ�ﵽ�µ�ƽ�⣩��__________

(4)�������[CO(NH2)2]�ļ�����Һ��������װ��ʾ��ͼ����ͼ,��д����A�缫�Ϸ����ĵ缫��Ӧʽ_____��

���𰸡� 2NH3(g)��CO2(g) ![]() CO(NH2)2(s)��H2O(g) ��H=��86.98kJ��mol��1 ���� ABD 6.25��10-5
CO(NH2)2(s)��H2O(g) ��H=��86.98kJ��mol��1 ���� ABD 6.25��10-5 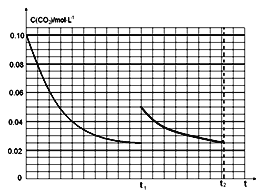 CO(NH2)2��8OH����6e��=N2����CO32-��6H2O
CO(NH2)2��8OH����6e��=N2����CO32-��6H2O
��������(l) ��Ӧ����2NH3(g)+CO2(g)NH2CO2NH4(s)��H1=-159.47 kJmol-1����Ӧ����NH2CO2NH4(s)CO(NH2)2(s)+H2O(g)��H2=+72.49kJmol-1�ɸ�˹�����ܷ�Ӧ��+��Ӧ�õ�2NH3(g)+CO2(g)CO(NH2)2(s)+H2O(g)��H3=-86.98kJmol-1����Ӧ����NH2CO2NH4(s)CO(NH2)2(s)+H2O(g)��H2=+72.49kJmol-1����H��0����S��0��Ҫʹ����G=��H-T��S��0����T��Ҫ�ϴ��÷�ӦΪ�����Է����ʴ�Ϊ��2NH3(g)��CO2(g) ![]() CO(NH2)2(s)��H2O(g) ��H=��86.98kJ��mol��1�����£�
CO(NH2)2(s)��H2O(g) ��H=��86.98kJ��mol��1�����£�
(2)A. �ϳ����صķ�Ӧ�Ƿ��ȷ�Ӧ���¶����{��ƽ�������ƶ���ƽ�ⳣ����С������Ϊ���壬���߲�������ƽ�ⲻ�ƶ�����A����B. �ϳ����صķ�Ӧ�Ƿ��ȷ�Ӧ�����¶ȵ���190��,���¶����{��ƽ�������ƶ���CO2ת������С����B����C. �¶�Խ�ߣ���������Ӧ�Ŀ�����Խ�ߣ��ᵼ�¶�����̼ת���ʼ�С����C��ȷ��D.����ͼ��ˮ̼��Խ�ߣ�������̼��ת����Խ�ͣ���D����ѡABD��
(3)�ں����½�0.4mol NH3��0.2mol CO2�����ݻ�Ϊ2L���ܱ������У��ﵽƽ��ʱ��
2NH3(g)+CO2(g)NH2CO2NH4(s)
��ʼ��(mol/L) 0.2 0.1 0
�仯��(mol/L)0.15 0.075
ƽ����(mol/L)0.05 0.025
�淴Ӧ��ƽ�ⳣ��K=![]() =0.052��0.025=6.25��10-5��t1ʱ�ﵽƽ�������c(CO2)��ʱ��t�仯����������ͼ2��ʾ���������������䣬t1ʱ���������ѹ����1L��������̼Ũ��Ӧ����0.05mol/L��ѹǿ����ƽ��������У������������ǹ��壬���Դﵽƽ��״̬��������̼Ũ�ȱ��ֲ��䣬�ݴ˻����仯����Ϊ��
=0.052��0.025=6.25��10-5��t1ʱ�ﵽƽ�������c(CO2)��ʱ��t�仯����������ͼ2��ʾ���������������䣬t1ʱ���������ѹ����1L��������̼Ũ��Ӧ����0.05mol/L��ѹǿ����ƽ��������У������������ǹ��壬���Դﵽƽ��״̬��������̼Ũ�ȱ��ֲ��䣬�ݴ˻����仯����Ϊ�� ���ʴ�Ϊ��6.25��10-5��
���ʴ�Ϊ��6.25��10-5�� ��
��
(4)�õ�ط�Ӧʱ��CO(NH2)2+2OH-![]() CO32-+N2��+3H2������Ԫ�ػ��ϼ���-3�۱�Ϊ0�ۣ�HԪ�ػ��ϼ���+1�۱�Ϊ0�ۣ��������ɵ����ĵ缫�����������������ĵ缫����������A�缫�Ϸ����ĵ缫��ӦʽΪCO(NH2)2��8OH����6e��=N2����CO32-��6H2O���ʴ�Ϊ��CO(NH2)2��8OH����6e��=N2����CO32-��6H2O��
CO32-+N2��+3H2������Ԫ�ػ��ϼ���-3�۱�Ϊ0�ۣ�HԪ�ػ��ϼ���+1�۱�Ϊ0�ۣ��������ɵ����ĵ缫�����������������ĵ缫����������A�缫�Ϸ����ĵ缫��ӦʽΪCO(NH2)2��8OH����6e��=N2����CO32-��6H2O���ʴ�Ϊ��CO(NH2)2��8OH����6e��=N2����CO32-��6H2O��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д� Ŀ�����ϵ�д�
Ŀ�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
�����仯�����ڹ�ҵ�����Ϳ�����������Ҫ����;����ش��������⣺
��1�� ��̬ Ni ԭ���У���������������ߵ��ܼ�����Ϊ______���۲���ӵĹ������ʽΪ________��
��2��Ni(CO)4 �������Ʊ��ߴ����ۣ����۵�Ϊ��19.3 �棬 �е�Ϊ 43 �档��
��Ni(CO)4 ���ۡ��е�ϵ͵�ԭ��Ϊ________��
�ڷ����� �� ���� �� ������Ŀ֮��Ϊ________��
��д��һ����CO ��Ϊ�ȵ�����������ӵķ���________��
��3�� NiSO4 �����ڵ�ƹ�ҵ������ SO42��������ԭ�ӵ��ӻ��������Ϊ________�����������ӻ����������________��
��4�� ���������Ȼ��Ƶľ���ṹ��ͬ���ɿ����������滻�����ӣ��������滻�����ӡ� ��
�������ӵ���λ��Ϊ________��
����Ȼ�ĺ��˹��ϳɵ������������ڸ���ȱ�ݣ�ijȱ�������������ΪNi0.97O�� ���� Ni Ԫ��ֻ�У�2 �ͣ�3 ���ּ�̬�� ���ּ�̬����������Ŀ֮��Ϊ________���������ӵ�������ֵΪNA�������ܶ�Ϊ �� g��cm��3����þ���������� O2��֮��ľ���Ϊ________pm��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݵȵ���ԭ�����ɶ�����Ԫ����ɵ����ӣ�ֻҪ��ԭ������ͬ����ԭ������������֮����ͬ���ɻ���Ϊ�ȵ����壬���Ǿ������ƵĽṹ���ԡ����¸������ӽṹ�����Ƶ���
A. CO��N2 B. O3��NO2�� C. CO2��N2O D. N2H4��C2H4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״���һ����Ҫ���Լ������Ź㷺����;����ҵ�Ͽ�����CO2�Ʊ��״���
(1) ��ӷ�:��CH4��CO2��Ӧ��H2��CO��������H2��CO�����Ƽ״���
��֪:
�� 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ��H1=-1450.0KJ/mol
�� 2CO(g)+O2(g)=2CO2(g) ��H2=-566.0KJ/mol
�� 2H2(g)+O2(g)=2H2O(l) ��H3=-571.6KJ/mol
��H2��CO��Һ̬�״����Ȼ�ѧ����ʽΪ_________��
(2)ֱ�ӷ�: H2��CO2���ض��������Ƽ״��ķ�ӦΪ:3H2(g)+CO2(g) ![]() CH3OH(g)+H2O(g)����ij�̶�������ܱ������г���һ������H2��CO2���ڴ�����һ���¶�������(ǰ30�������¶�ΪT0 ��)����÷�Ӧ��Ũ����ʱ��Ĺ�ϵ����ͼ��ʾ��
CH3OH(g)+H2O(g)����ij�̶�������ܱ������г���һ������H2��CO2���ڴ�����һ���¶�������(ǰ30�������¶�ΪT0 ��)����÷�Ӧ��Ũ����ʱ��Ĺ�ϵ����ͼ��ʾ��

�ش���������:
�ٸ÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽK=_________;��T0�淴Ӧ�ﵽƽ��ʱ���״����������Ϊ_________��(������λ��Ч����)
�ڱ����¶Ⱥ�������䣬���������˵����Ӧһ���ﵽƽ��״̬����_______��(����ĸ����)
a.��������ܶȲ���
b.��Ӧ��ϵѹǿ����
c.H2�� CO2��Ũ��֮��Ϊ3:1
d.ÿ����3mol��H-H��ͬʱ����3molC-H��
�������������䣬�¶ȵ���T1�� (T1>T0)������Ӧ�ﵽƽ��ʱ���ƽ�ⳣ��ΪK1(K10)����÷�ӦΪ_____________(����ȷ�Ӧ���������ȷ�Ӧ��)��
����30����ʱ��ͨ���ı�CO2��Ũ��(��0.5mol/L����1.0mol/L)������ͼʾ�仯��ͨ������˵��ֻ�ı�������ܷ���45����ʱ��ƽ��״̬(K2)___________��(��ؽ��������λ��Ч����)
(3)�״�����ȼ�ϵ�ص�ԭ�ϣ����������ҺΪ���ᣬ�����·ת��12mol����ʱ(�����ǵ�����ʧ)��������������������ȫ��ͨ�뵽2L 1.5mol/L��NaOH��Һ�У���ַ�Ӧ������Һ���������ӵ����ʵ���Ũ���ɴ�С��˳��Ϊ______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£����ܱ�������ֱ�������������1mol����һ�������³�ַ�Ӧ�ָ���ԭ�¶�ʱ��ѹǿ����Ϊ��ʼʱ��1/4����ԭ�����������ǣ� ��
A. H2��O2 B. HCl��NH3 C. H2��Cl2 D. CO��O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��ȥ����CO2�е�SO2��O2�������Լ���ʹ��˳����ȷ���ǣ� (�� ��)
������Na2CO3��Һ��������NaHCO3��Һ����ŨH2SO4��Һ�������ȵ�ͭ��������ʯ��
A���٢ۢ� B���ڢۢ� C���ڢܢ� D���ۢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������棨CeO2����һ����Ҫ��ϡ�������ƽ�������ʾ�����������в��������ķϲ�����ĩ����SiO2��Fe2O3��CeO2��FeO�����ʣ���ij�������Դ˷�ĩΪԭ�ϣ�������¹������̶���Դ���л��գ��õ�������CeO2��������茶��塣

��֪��CeO2������ϡ���ᣬҲ������NaOH��Һ��
��1��ϡ��A�ķ���ʽ��___________________��
��2����Һ1�м���H2O2��Һ��Ŀ����________________________________��
��3��ijͬѧ���ʵ��֤����Һ1�к���Fe2+�������õ��Լ�Ϊ________________��
��4����֪��Һ�е�Fe2+���Ժ�������ˮ��FeO(OH)��Ӧ����Fe3O4������д�÷�Ӧ�����ӷ���ʽ___________________________________��
��5������Һ2����Ce(OH)4�����ӷ���ʽ_____________________��
��6��������茶���[Fe2(SO4)3��2(NH4)2SO4��3H2O]�㷺����ˮ�ľ����������������ӷ���ʽ����������ԭ����______________________________�������ȥ�����Է�ˮ������ȥ�����Է�ˮ�е�������ʱЧ��_________�����ǿ�����͡�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��������Ϊ98%��Ũ���ᣬ�ܶ�Ϊ1.84g/mL�������й�˵������ȷ����
A. ���������ʵ���Ũ��Ϊ18.4mol/L
B. ȡ10mL����Һ���ӵ�������ˮ��Ϻ������������ʵ���Ũ��С��9.2mol/L
C. ȡ10g����Һ����������ˮ��Ϻ��������������ٷֱ�Ũ�ȴ���49%
D. ��������ʢ����U������У�����������H2��SO2��H2S������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���Ľṹ��ʽ�����á�����ʽ����ʾ�������߱�ʾ�����ߵĽ�����̵㴦����̼ԭ�ӣ�������ԭ�Ӳ����ļۣ���C��Hԭ��δ��dz�������֪����ijд�л���֮���ת��������̫���ܣ��罵��Ƭ��ϩ(NBD)��̫��������ת�����Ļ���(Q)�ķ�ӦΪ�� �����������д������
����������������
A. �÷�ӦΪ���ȷ�Ӧ B. Q���ȴ���ֻ��3��
C. NBD��Q��Ϊͬ���칹�� D. NBD��ͬ���칹������Ƿ�����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com