
����Ŀ����þԭ�Ӻ�����____�ֲ�ͬ�˶�״̬�ĵ��ӣ�____�ֲ�ͬ����״̬�ĵ��ӣ�
��A��B��C��D��E����5��Ԫ�ء�����գ�
��1��AԪ�ػ�̬ԭ�ӵ��������3��δ�ɶԵ��ӣ��������2�����ӣ���Ԫ�ط���Ϊ_____
��2��BԪ�صĸ�һ�����ӵĵ��Ӳ�ṹ�����ͬ��B��ԭ�ӽṹʾ��ͼΪ_____
��3��CԪ���ǵ�����������δ�ɶԵ��ӵ�����Ԫ�أ����ĵ����Ų�ͼΪ_____
��4��DԪ�ػ�̬ԭ�ӵ�M��ȫ������N����һ�����ӣ�D��̬ԭ�ӵĵ����Ų�ʽΪ_____
��5��Eԭ�ӹ���3���۵��ӣ�����һ���۵���λ�ڵ����ܲ�d�����ָ����Ԫ�������ڱ�����������������������_____
�磮�÷��š�������������=���������и����ϵ��
��1����һ�����ܣ�N_____O��Mg_____Ca��
��2���縺�ԣ�O_____F��N_____P��
��3�������ߵͣ�ns_____np��4s_____3d��
���𰸡� 12 4 N 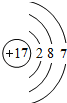
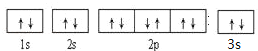 1s22s22p63s23p63d104s1��[Ar]3d104s1 �������ڡ�IIIB�� �� �� �� �� �� ��
1s22s22p63s23p63d104s1��[Ar]3d104s1 �������ڡ�IIIB�� �� �� �� �� �� ��
����������������һ������þ�ĺ�������Ų�ʽ���
����������ԭ�ӻ����ӵĺ�������Ų�ȷ��Ԫ�ص�����������ȷ��Ԫ�ص����࣬���������
���������ݵ�һ�����ܡ��縺�Եı仯�����Լ�����ԭ�����
��⣺��һ��Mg��ԭ��������12����������Ų�ʽΪ1s22s22p63s2����þԭ�Ӻ�����12�֣�
��������1����̬ԭ�ӵ��������3��δ�ɶԵ��ӣ��������2�����ӵ�Ԫ���ǵ�Ԫ�أ�Ԫ�ط���ΪN��
��2��B-�ĵ��Ӳ�ṹ�����ͬ��BΪClԪ�أ���ṹʾ��ͼΪ ��
��
��3��CԪ���ǵ�����������δ�ɶԵ��ӵ�����Ԫ�أ�C��Mg��Mg���еĺ��������Ϊ12������������Ų�ʽΪ1s22s22p63s2�������Ų�ͼΪ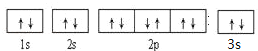 ��
��
��4��DԪ�ػ�̬ԭ�ӵ�M��ȫ������N��ֻ��һ��δ�ɶԵ��ӣ�ӦΪCuԪ�أ�������Ų�ʽΪ1s22s22p63s23p63d104s1��[Ar]3d104s1��
��5��EԪ��ԭ�ӹ���3���۵��ӣ�����һ���۵���λ�ڵ����ܲ�d������۵����Ų�ʽΪ3d14s2������ǰ��ĵõ���������Ų�ʽ1s22s22p63s23p63d14s2������ܲ���Ϊ4��˵��λ�ڵ������ڣ��۵����Ų�ʽΪ3d14s2��˵��λ�ڵڢ�B�壻
��������1���ǽ�����Խǿ����һ������Խ�����ڰ������ȫ������״̬��һ�����ܴ�������Ԫ�أ����һ�����ܣ�N��O��Mg��Ca��
��2���ǽ�����Խǿ���縺��Խ����縺�ԣ�O��F��N��P��
��3�����ݹ���ԭ����֪�����ߵͣ�ns��np��4s��3d��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ѱ۳����ᣨ��Ҫ�����ᡢFe3+��Fe2+��TiO2+��Al3+���Ʊ����������[��NH4��2S2O8]��ͬʱ����TiO��OH��2�ļ�Ҫ�������£�
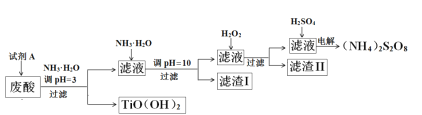
��֪��i.����������ȫ�����������������pH
�������� | TiO2+ | Fe3+ | Fe2+ | Al3+ |
��ʼ������PH | 1.2 | 1.9 | 7.0 | 3.2 |
������ȫ��pH | 2.8 | 3.1 | 9.4 | 4.7 |
ii.pH>7ʱ��Fe2+��������Fe��II����������[Fe��NH3��2]2+��
��ش��������⣺
��1��Ϊ��֤����TiO(OH)2�Ĵ��ȣ������Լ�AҪ�������Լ�AΪ___________��
��2�����ջ��յ�TiO��OH��2����õ�TiO2�ᷢ�ƣ����Ƶ����ʿ�����_______���ѧʽ����
��3������I����Ҫ�ɷֳ�Fe(OH)2��Al��OH��3�⣬������______________��
��4������H2O2��Ŀ������������Fe��II����������[Fe��NH3��2]2+����ƽ�������ӷ���ʽ��2[Fe��NH3��2]2+ +________+4H2O +H2O2 =_______ + 4NH3��H2O
��5������Ʊ���������淋�װ������ͼ��ʾ��
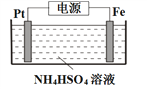
��S2O82-��SԪ�صĻ��ϼ�Ϊ+6�����й���������ĿΪ___________��
�ڵ��ʱ�����缫���ӵ�Դ��___________����
�۳����£����Һ�к�������Ҫ������ʽ�� pH �Ĺ�ϵ����ͼ��ʾ��
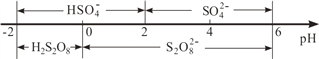
�������ŵ��������ҪΪHSO4-���������������Һ�� pH ��ΧΪ______�������ĵ缫��ӦʽΪ______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ȡ�봢��������Դ����������о��ȵ㡣�ش���������:
(1)ֱ���ȷֽⷨ����
ij�¶���2H2O(g) ![]() 2H2(g) +O2(g)���÷�Ӧ��ƽ�ⳣ������ʽΪ K= ________��
2H2(g) +O2(g)���÷�Ӧ��ƽ�ⳣ������ʽΪ K= ________��
(2)�Ҵ�ˮ������������
��Ӧ���̺ͷ�Ӧ��ƽ�ⳣ��(K)���¶�(T)�ı仯������ͼ 1 ��ʾ��ij�¶�����ͼ 1 ��ʾ��Ӧÿ����1mol H2(g)�������仯�� 62 kJ����÷�Ӧ���Ȼ�ѧ����ʽΪ________________
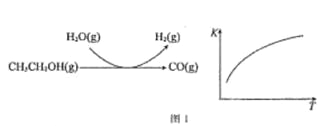
(3)ˮú��������
CO(g)+ H2O(g) ![]() CO2(g) +H2(g) ��H<0���ڽ�����[n(CO):n(H2O)]��ͬʱ�������Ӧ�� CO ��ƽ��ת���ʼ�ͼ 2(ͼ�и����Ӧ�ķ�Ӧ�¶ȿ�����ͬ��Ҳ���ܲ�ͬ)��
CO2(g) +H2(g) ��H<0���ڽ�����[n(CO):n(H2O)]��ͬʱ�������Ӧ�� CO ��ƽ��ת���ʼ�ͼ 2(ͼ�и����Ӧ�ķ�Ӧ�¶ȿ�����ͬ��Ҳ���ܲ�ͬ)��
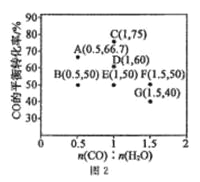
���� 2 L ���º����ܱ������м���һ������ CO �� 0.1mol H2O(g)����ͼ�� G ���Ӧ�¶��£���Ӧ��5 min �ﵽƽ������ƽ����Ӧ���� v(CO)=___________��
��ͼ�� B��E �����Ӧ�ķ�Ӧ�¶ȷֱ�Ϊ TB �� TE���� TB ___________TE (����>���� <������=��)��
�۾�������A��E��G �����Ӧ�ķ�Ӧ�¶ȶ���ͬ(��Ϊ T��)����ԭ���� A��E��G �����Ӧ�� _______��ͬ��
�ܵ� T��ʱ������һ�ݻ��ɱ���ܱ�������ͬʱ���� 3.0 mol CO��1.0 mol H2O(g)��1.0 molCO2 ��xmol H2��ʹ������Ӧ��ʼʱ������Ӧ������У���xӦ�����������_________��
(4)��绯ѧ�ֽ�����

��Ӧԭ����ͼ3�������ȹ�缫�ĵ缫��ӦʽΪ 4OH--4e-=O2��+2H2O���缫�ĵ缫��ӦʽΪ ________��
(5)Mg��Cu ��һ�ִ���Ͻ�
350��ʱ��Mg��Cu �� H2 ��Ӧ������ MgCu2 �ͽ���һ�ֽ���Ԫ�ص��⻯��(���������������ԼΪ 7.7%)���÷�Ӧ�Ļ�ѧ����ʽΪ_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ���ܻ�óɹ����ǣ� ��
A.��ϡ�������Ҵ����Һ���ȿ�����170������ϩ����
B.����м����ˮ����������屽
C.�ڱ�����Һ�е�������ϡ��ˮ���ְ�ɫ����
D.��ͭ˿�ھƾ����ϼ��Ⱥ�����������ˮ�Ҵ��У�ͭ˿�ָ���ԭ���ĺ�ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������һ�����ڴ�л���ṹ��ʽΪCH3��CH��OH����COOH���Իش�
��1����������к��еĹ�������_____ ��_____���������ƣ�
��2������ܷ����ķ�Ӧ��_____������ţ�
A��������Ӧ B��ȡ����Ӧ C���ӳɷ�Ӧ D����ȥ��Ӧ��
��300����ǰ��������ѧ�Ҳ����������������ûʳ�������ɫ��Ӧ�����ɴ˷���������īˮ��ûʳ����ĽṹʽΪ��

��1����ûʳ��������īˮ��Ҫ������_____���������ʣ�������ţ�
A���� B���� C��ȩ D������
��2��д��ûʳ����������������Һ���ȷ�Ӧ�Ļ�ѧ����ʽ��_______________��
���ڢ�CH2=CH2 ��![]() ��CH3CH2OH ��CH3COOH �ݾ���ϩ���������У�
��CH3CH2OH ��CH3COOH �ݾ���ϩ���������У�
��1�����ڸ߷��ӻ��������_____�����������ʵ���ţ���ͬ������
��2����ʹBr2��CCl4��Һ��ɫ����_____��
��3�����ܷ���ȡ����Ӧ���ܷ����ӳɷ�Ӧ����_____��
��4������Na2CO3��Һ��Ӧ����_____��
��5���ܷ���������Ӧ����_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״���CH3OH��������Ϊ��ɫҺ�壬��Ӧ�ù㷺�Ļ���ԭ�Ϻ�ǰ���ֹ۵�ȼ�ϡ�
��1���ټ�֪��CO��H2��CH3OH��ȼ���ȣ���H���ֱ�Ϊ��283.0 kJmol-1����285.8 kJmol-1��-726.8 kJmol-1����CO��H2��Ӧ����CH3OH���Ȼ�ѧ����ʽ��________________��
�����������ۺ�����̫���ܽ���Ȼ��ת��Ϊ���״��˵ļ״���װ������ͼ��װ�ù���ʱ������Ӧ����ʽΪ_________________________________��

��2��һ���¶��·�ӦCO(g)+2H2(g)=CH3OH(g)���ݻ�Ϊ2L���ܱ������н��У���������ݼ���ͼ��
�ٴӷ�Ӧ��ʼ��ƽ��ʱ����H2��ʾ��ѧ��Ӧ����Ϊ__________�����¶��´˷�Ӧ��ƽ�ⳣ��Ϊ__________��
��5min�����ʱ仯�Ӿ��ԭ�������___________________________��
��3����6.98MPa��250��ʹ���(CoI2)�����£��״���ת��Ϊ���
CH3OH(g) + CO(g) = CH3COOH(g)
�л��ϳɳ��и���Ӧ���ڡ�����Ӧ����CH3OH��CO���ϱ�(����)Ϊ1,�״����������ѡ����Ϊ90.0%����˷�ӦCO��ת����Ϊ___________��
��4������Ka(CH3COOH)=1.8��10-5�� 0.1 molL-1CH3COOH��Һ�еμ�0.1 molL-1CH3COONa��Һ�� pH=7����ʱ�����Һ�������ʵ����ʵ�����n(CH3COOH):n(CH3COONa)=___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������dzµ��㡱������Ϊ�����������������������ζ��������������ʵ��������Ҳ��������ͼ��ʾ��װ����ȡ�����������ش��������⡣

(1)��ϩ��ȡ�Ҵ��Ļ�ѧ����ʽ��__________________________��
(2)д����ȡ���������Ļ�ѧ��Ӧ����ʽ��________________________��
(3)Ũ��������ã�_______________________________��
(4)����̼������Һ����Ҫ������________________________________________��
(5)װ���е���Ҫ�ڱ���̼������Һ��Һ���ϣ����ܲ�����Һ�У�Ŀ����__________��
(6)��Ҫ���Ƶõ������������������Ӧ�ò��õ�ʵ�������___________________��
(7)����ʵ��ʱ����ʱ��Ҫ��ʢ�������������Թ�����뼸�����Ƭ����Ŀ����________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ����Ƽ����Ӧ�����ӷ���ʽ����ȷ����
A. ��FeCl3��Һ��ʴͭ������ӡˢ��·��:Fe3++Cu=Cu2++Fe3+
B. ��Na2CO3��Һ����ˮ���е�CaSO4:CO32-+CaSO4![]() CaCO3+SO42-
CaCO3+SO42-
C. ̼������Һ�Լ���:CO32-+2H2O=HCO3-+2OH-
D. ��NaOH��Һ��������:Cl2+2OH-=2Cl-+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ö��Ե缫���һ��Ũ�ȵ�����ͭ��Һ����ʱ��ͨ�����������Һ�м���0.2mol Cu(OH)2ǡ�ûָ������ǰ��Ũ�Ⱥ�pH�����������ת�Ƶ��ӵ������ʵ���Ϊ ( )
A.0.2molB.0.6molC.0.4molD.0.8mol
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com