
【题目】25℃时,用0.1000mol·L-1的NaOH溶液分别滴定20.00mL均为0.1000mol·L-1的三种酸HX、HY、HZ ,滴定曲线如图所示。下列说法错误的是
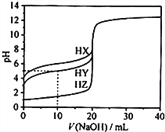
A. HZ是强酸,HX、HY是弱酸
B. 根据滴定曲线,可得Ka(HY)≈10-5
C. 将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X-)>c(Y-)>c(OH-)>c(H+)
D. 将上述HY与HZ溶液等体积混合达到平衡时:C(H+)=c(OH-)+c(Z-)+c(Y-)
科目:高中化学 来源: 题型:
【题目】25℃时,浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg![]() 的变化如图所示,下列叙述错误的是 ( )
的变化如图所示,下列叙述错误的是 ( )
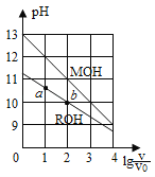
A.当lg![]() = 2时,若两溶液同时升高温度,则
= 2时,若两溶液同时升高温度,则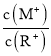 增大
增大
B.MOH的碱性强于ROH的碱性
C.ROH的电离程度:b点大于a点
D.两溶液分别与盐酸反应完全,则消耗HCl的物质的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:常温下,pKa(HNO2)=-lgKa(HNO2)=3.37。在体积均为20mL、浓度均为0.1mol/L的HNO3溶液、HNO2溶液中滴加同浓度的NaOH溶液,溶液的导电离与NaOH溶液体积关系如图所示。下列说法错误的是
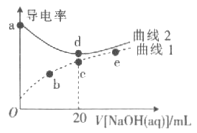
A.曲线1代表HNO2溶液
B.常温下,c、d点溶液的pH都为7
C.加水稀释b点溶液,水的电离程度增大
D.常温下,a、e点溶液中Kw相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】冰晶胞中水分子的空间排列方式与金刚石晶胞(其晶胞结构如图,其中空心球所示原子位于立方体的顶点及面心,实心球所示原子位于立方体内)类似。有关冰晶胞的说法合理的是

A.冰晶胞内水分子间以共价键相结合
B.晶体冰与金刚石晶体硬度都很大
C.冰分子间的氢键具有方向性和饱和性,也是一种σ键
D.氢键的存在导致冰晶胞与金刚石晶胞微粒的排列方式类似
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为实验室模拟工业上催化裂化的装置示意图,根据图示回答下列问题。

(1)工业上石油裂化的主要目的是_______________________。
(2)A中氧化铝的作用是_____________,B中冷水的作用是___________________。
(3)C中得到的液体具有汽油的气味,该液体________________(填“能”或“不能”,下同)通过化学反应使溴水褪色,而通过石油分馏得到的汽油_______________通过化学反应使溴水褪色。
(4)D中酸性高锰酸钾溶液褪色,说明石蜡裂化时除有液态不饱和烃生成外,还有__________生成。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是
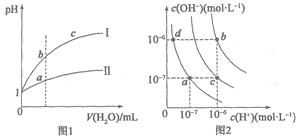
A.图1表示相同温度下pH=1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线II为盐酸,且b点溶液的导电性比a点强
B.图1中,中和等体积的两种酸,消耗等浓度的NaOH溶液体积V(I)>V(II)
C.图2中纯水仅升高温度,就可以从a点变到c点
D.图2中在b点对应温度下,将pH=2的H2SO4与pH=10的NaOH溶液等体积混合后,溶液显中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是可以综合利用的。从海水中提取食盐和溴的过程如下:
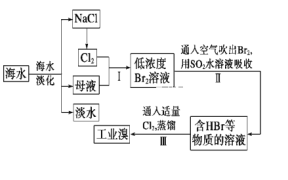
(1)请写出一种海水淡化的方法:__。
(2)步骤Ⅰ获取Br2的离子方程式为___。
(3)步骤Ⅱ用SO2水溶液吸收Br2,使溴蒸气转化为氢溴酸以达到富集的目的。其反应的化学方程式为Br2+SO2+2H2O=H2SO4+2HBr,在该反应中,氧化剂是__(填化学式)。若反应中生成2molHBr,则消耗___molSO2。
(4)根据上述反应判断SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在室温下,下列五种溶液:①0.1 mol/L NH4Cl溶液,②0.1 mol/L CH3COONH4溶液,③0.1 mol/L NH4HSO4溶液,④0.1 mol/L 氨水,⑤0.1 mol/L NH3·H2O和0.1 mol/L NH4Cl混合液(显碱性)。请根据要求填写下列空白:
(1)溶液①呈____________性(填“酸”、“碱”或“中”),其原因是___________(用离子方程式表示)
(2)在上述①、②、③、④溶液中c(NH4+)浓度由大到小的顺序是_________。(填序号)
(3)在溶液⑤中,各离子浓度大小顺序为___________。
(4)室温下,测得溶液②的pH=7,则 CH3COO—与NH4+浓度的大小关系是c(CH3COO—)________c(NH4+)(填“>”、“<”或“=”)。
(5)常温下,0.1 mol/ L CH3COOH溶液加水稀释过程中,下列表达式的数值变大的是____________(填字母)。
A. c(H+) B. c(H+)/ c(CH3COOH) C. c(H+)·c(OH-)
D. c(OH-)/ c(H+) E. c(H+)·c(CH3COO-) / c(CH3COOH)
(6)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d 四种短周期元素在周期表中的位置如图所示,a 和 b 分别位于周期表的第 2 列和第 13 列, 下列叙述正确的

A.离子半径 b>d
B.b 可以和强碱溶液发生反应
C.c 的氢化物空间结构为三角锥形
D.a 的最高价氧化物对应水化物是强碱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com