
| A. | 强电解质溶液一定比弱电解质溶液导电能力强 | |
| B. | 强电解质的水溶液中不存在溶质分子,弱电解质溶液中已电离的离子和未电离的分子共存 | |
| C. | 强电解质都是离子化合物,弱电解质都是共价化合物 | |
| D. | 不溶性盐都是弱电解质,可溶性酸都是强电解质 |
分析 A.溶液的导电能力和离子浓度成正比;
B.强电解质在水溶液里完全电离,弱电解质在水溶液里部分电离;
C.强电解质不一定是离子化合物;
D.某些不溶性盐是强电解质;某些可溶性酸是弱电解质.
解答 解:A.溶液的导电能力与离子浓度成正比,与电解质的强弱无关,故A错误;
B.强电解质在水溶液里完全电离,弱电解质在水溶液里部分电离,所以弱电解质溶液中已电离的离子和未电离的分子共存,故B正确;
C.硫酸、HCl是强电解质,但硫酸、HCl是共价化合物,故C错误;
D.不溶性盐不一定是弱电解质,如硫酸钡;可溶性酸不一定是强电解质,如醋酸是弱电解质,故D错误;
故选B.
点评 本题考查电解质和非电解质判断,根据概念来分析解答,明确电解质和非电解质、强弱电解质的划分标准,难度不大.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Z>Y>X | |
| B. | Z与X形成化合物的酸性弱于Z的同族元素与X形成化合物的酸性 | |
| C. | CaY2与水发生氧化还原反应时,CaY2只作氧化剂 | |
| D. | CaX2、CaY2和CaZ2等3种化合物中,阳离子与阴离子个数比均为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该分散系的分散质为Fe2O3 | |
| B. | 加入NaOH时发生的反应可能为:Fe2++2Fe3++8OH-=Fe3O4+4H2O | |
| C. | 在电场作用下,阴极附近分散系黑色变深,则说明该分散系带正电荷 | |
| D. | 可用过滤的方法将黑色金属氧化物与Na+分离开 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol H2O2晶体中含有2molH+,但不自由移动 | |
| B. | 1mol羟基中含有的电子数为7NA | |
| C. | 14g己烯和聚乙烯的混合物完全燃烧生成的CO2分子数为NA | |
| D. | 标况下,22.4L溴乙烷中含有的共价键数为7NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
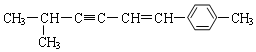 说法正确的是( )
说法正确的是( )| A. | 该分子中所有的碳原子均可能处于同一平面上 | |
| B. | 该分子中一定共面的碳原子数至少为8个 | |
| C. | 该分子中至少有9个碳原子处于同一条直线上 | |
| D. | 该分子中可能处于同一平面的原子总数最多为18个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Si→SiO2→H2SiO3→Na2SiO3 | B. | Fe→Fe(OH)3→Fe2O3→Fe(NO3)3 | ||
| C. | HCl→Cl2→HClO→NaClO | D. | Al→Al2O3→Al(OH)3→AlCl3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com