
【题目】下列能够获得有机物所含官能团信息的方法是
A. 红外光谱 B. 质谱法 C. 色谱法 D. 核磁共振氢谱
科目:高中化学 来源: 题型:
【题目】关于化学键的下列叙述中, 正确的是 ( )
A.离子化合物中可能含共价键B.共价化合物中可能含离子键
C.离子化合物中只含离子键D.只含共价键的物质一定是共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化镁(Mg3N2) 在工业上具有非常广泛的应用。某化学兴趣小组用镁与氮气反应制备Mg3N2并进行有关实验。实验装置如下所示:
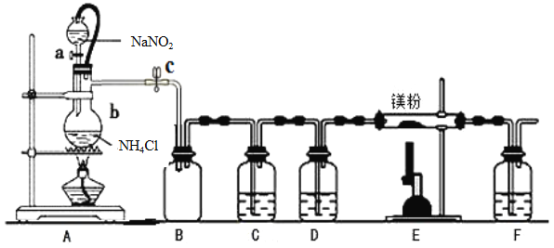
已知:①氮化镁常温下为浅黄色粉末,极易与水反应。
②亚硝酸钠和氯化铵制取氮气的反应剧烈放热,产生氮气的速度较快。
③温度较高时,亚硝酸钠会分解产生O2等。
回答下列问题:
(1)仪器a、b的名称分别是____________,____________;写出装置A 中发生反应的化学方程式____________。
(2)装置C中为饱和硫酸亚铁溶液,作用是_________,该装置中发生反应的离子方程式为____________;装置D 中的试剂是____________,F 装置的作用是____________。
(3)加热至反应开始发生,需移走A 处酒精灯,原因是____________。
(4)实验结束后,取装置E的硬质玻璃管中的少量固体于试管中,加少量蒸馏水,把润湿的红色石蕊试纸放在管口,观察实验现象,该操作的目的是______________。反应的化学方程式为操作的目的是__________;再弃去上层清液,加入盐酸,观察是否有气泡产生,该操作的目的是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析下面化学键键能数据,判断下列分子中受热时最不稳定的是( )
化学键 | H-H | H-F | H-Br | H-I |
键能(kJ/mol) | 436 | 565 | 368 | 297 |
A.氢气B.氟化氢C.溴化氢D.碘化氢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用合成气(CO和H2)制取乙醇的反应为2CO+4H2![]() CH3CH2OH+H2O。研究发现,使用TiO2作为载体负载铑基催化剂具有较高的乙醇产量。回答下列问题:
CH3CH2OH+H2O。研究发现,使用TiO2作为载体负载铑基催化剂具有较高的乙醇产量。回答下列问题:
(1)Ti基态原子核外电子排布式为_________。和O同一周期且元素的第一电离能比O大的有______(填元素符号),和O同一周期且基态原子核外未成对电子数比O多的有____(填元素符号)。
(2)H2O分子中O原子的价层电子对数是________,CH3CH2OH分子中亚甲基(-CH2-)上的C原子的杂化形式为_______。
(3)在用合成气制取乙醇反应所涉及的4种物质中,沸点从低到高的顺序为_________,原因是__________。
(4)工业上以CO、O2、NH3为原料,可合成氮肥尿素[CO(NH2)2],CO(NH2)2分子中含有的σ键与π键的数目之比为_________。
(5)C元素与N元素形成的某种晶体的晶胞如图所示(8个碳原子位于立方体的顶点,4个碳原子位于立方体的面心,4个氮原子在立方体内),该晶体硬度超过金刚石,成为首屈一指的超硬新材料。
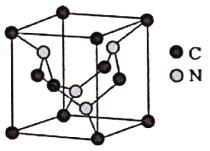
①该晶体硬度超过金刚石的原因是____________。
②已知该晶胞的密度为d g/cm3,N原子的半径为r1cm,C原子的半径为r2cm,设NA为阿伏加德罗常数,则该晶胞的空间利用率为________(用含d、r1、r2、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L密闭容器内,800 ℃时反应:2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间/(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/(mol) | 0.20 | 0.10 | 0.08 | 0.07 | 0.07 | 0.07 |
(1)达到平衡的时间是________,理由是___________________。
(2)如图中表示NO2的浓度变化的曲线是________。用O2表示从0~2 s内该反应的平均速率v=________。

(3)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2)
b.容器内各物质的浓度保持不变
c.v逆(NO)=2v正(O2)
d.达到化学平衡时,NO将完全转化为NO2
(4)能增大该反应的反应速率的是________。
a.及时分离出NO2气体
b.适当升高温度
c.增大O2的浓度
d.选择高效催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学校化学学习小组为探究二氧化氮的性质,按如图所示装置进行实验。
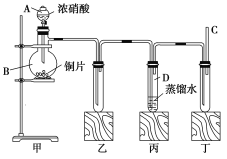
回答下列问题:
(1)装置甲中盛放浓硝酸的仪器A的名称是_____,该装置中发生反应的化学方程式为___。
(2)实验过程中,装置乙、丙中出现的现象分别是__________、____________;装置丙中的试管内发生反应的离子方程式为________________(不是离子反应的不写)。
(3)取下装置丙中的试管D,在其中滴加FeSO4溶液,溶液变为________色,为了证明铁元素在该反应中的产物,可以再向溶液中滴加KSCN溶液,溶液变为________色。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com