
【题目】在2 L密闭容器内,800 ℃时反应:2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间/(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/(mol) | 0.20 | 0.10 | 0.08 | 0.07 | 0.07 | 0.07 |
(1)达到平衡的时间是________,理由是___________________。
(2)如图中表示NO2的浓度变化的曲线是________。用O2表示从0~2 s内该反应的平均速率v=________。

(3)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2)
b.容器内各物质的浓度保持不变
c.v逆(NO)=2v正(O2)
d.达到化学平衡时,NO将完全转化为NO2
(4)能增大该反应的反应速率的是________。
a.及时分离出NO2气体
b.适当升高温度
c.增大O2的浓度
d.选择高效催化剂
【答案】3 s3 s以后NO的浓度(或物质的量)不再发生改变b0.015 mol/(L·s)bcbcd
【解析】
(1)根据化学平衡概念:(2)根据v=△c/△t计算从0~2s内v(NO),再由反应速率之比=化学计量数之比计算v(O2);(3)根据影响化学反应平衡的因素判断.(4)根据影响化学反应速率的因素判断.
(1)达到平衡时,各组分的浓度保持不变,由表中数据可以看出,3 s以后NO的物质的量已经不再改变,故达到平衡。(2)由表格数据可知,NO逐渐减少,故NO2应逐渐增加,达到平衡时NO2的物质的量为0.13 mol,表的纵坐标为物质的量浓度,故b为NO2浓度变化曲线;在0~2 s内v(NO)=![]() mol·(L·s)-1=0.03 mol·(L·s)-1,根据化学方程式可知v(O2)=
mol·(L·s)-1=0.03 mol·(L·s)-1,根据化学方程式可知v(O2)=![]() v(NO)=0.015 mol·(L·s)-1。(3)反应达到平衡时,正逆反应速率相等,各组分浓度保持不变,a中未标明代表正反应还是逆反应,不能说明达到平衡;d中反应达到平衡时,NO不可能完全转化为NO2。故选bc;(4)分离出NO2气体,降低生成物的浓度,能降低反应速率;升高温度,反应速率加快;增大氧气浓度,反应速率加快,催化剂的加入能加快反应速率。
v(NO)=0.015 mol·(L·s)-1。(3)反应达到平衡时,正逆反应速率相等,各组分浓度保持不变,a中未标明代表正反应还是逆反应,不能说明达到平衡;d中反应达到平衡时,NO不可能完全转化为NO2。故选bc;(4)分离出NO2气体,降低生成物的浓度,能降低反应速率;升高温度,反应速率加快;增大氧气浓度,反应速率加快,催化剂的加入能加快反应速率。
a.及时分离出NO2气体,反应正方向移动,但是反应速率减小,故a错误;b.适当升高温度,化学反应速率加快,故b正确;c.增大O2的浓度,反应正方向移动,化学反应速率加快,故c正确;d.选择高效催化剂,能加快反应速率,故d正确;故选bcd。


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】下列常见物质的俗名与化学式对应正确的是
A.醋酸——CH3CH2OHB.烧碱——NaOH
C.石灰石——Ca(OH)2D.小苏打——Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应Fe+H2SO4===FeSO4+H2↑的能量变化趋势如下图所示:

(1)该反应为________反应(填“吸热”或“放热”)。
(2)若要使该反应的反应速率加快,下列措施可行的是__________(填字母)。
A.改铁片为铁粉 B.改稀硫酸为98%的浓硫酸 C.升高温度
(3)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为________极(填“正”或“负”)。铜电极上产生的现象为____________,该极上发生的电极反应为____________________,外电路中电子由____________极(填“正”或“负”,下同)向________极移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有四种短周期元素,它们的结构、性质等信息如表所述:
元素 | 结构、性质等信息 |
X | 构成有机物的核心元素,该元素的一种氧化物和气态氢化物都是典型的温室气体 |
Y | 短周期中(除稀有气体外)原子半径最大的元素,该单质与冷水剧烈反应 |
Z | 与Y同周期,其最高价氧化物的水化物呈两性 |
M | 海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒剂和杀菌剂 |
请根据表中信息填写:
(1)X元素在周期表中的位置________;其相对分子质量最小的气态氢化物常用作______。
(2)工业上制取Y单质常用的方法是(用化学方程式表示)_________。
(3)Y离子半径比Z离子的半径________(填“大”或“小”)。
(4)Z的单质和氧化铁反应可用于野外焊接钢轨,该反应属于________(填“吸热”或“放热”)反应,写出反应的化学方程式为______________。
(5)举出实例说明M的非金属性比X强:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校合作学习小组的同学设计实验验证Na2SO4与焦炭高温加热后的产物。回答下列问题。
(1)Na2SO4与焦炭反应的实验装置如下图所示:
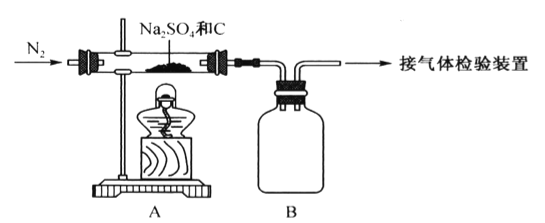
①先通入N2,然后加热,直至反应结束,整个过程中N2的作用是__________________________。
②装置B的作用是___________。
(2)该同学认为气体产物中可能含有CO2、CO 及SO2,并进行验证,选用上述实验中的装置A、B和下图所示的部分装置(可以重复选用)进行实验。
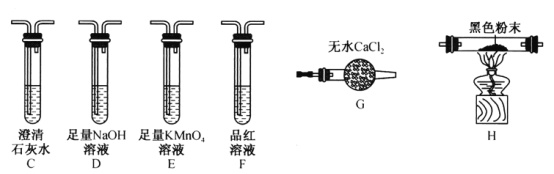
①实验装置连接的合理顺序为A、B、___________。装置H中黑色粉末是___________。
②能证明产物中有CO的现象是____________________________________________。
③若含有SO2,E装置的作用是______________________________(用化学方程式说明)。
(3)某同学利用下图装置验证固态产物,能证明固态产物中含有Na2S的现象是___________。若实验中发现固态产物完全反应后,锥形瓶底部还产生少量黄色沉淀,说明固体产物中除含有Na2S外,还含有少量的___________(填一种可能的物质)。
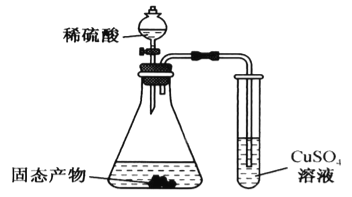
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.5mol (NH4)2S的质量为__g。
(2)标准状况下,1.7 g NH3与__LH2S气体含有的氢原子数相同。
(3)标准状况下,1.6g某气态氧化物RO2体积为0.56L,该气体的物质的量为__mol,RO2的相对分子质量为__。
(4)与0.2molH2含有相同电子数目的氦气分子的物质的量为_____。
(5)标准状况下, NH3与CH4组成的混合气体的平均密度为0.75g/L,该混合气体的平均摩尔质量为____,该气体对氢气的相对密度为___,NH3的体积分数为____。
(6)同温同压下,等体积的CO和CO2的物质的量之比__,所含氧元素的质量比__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com