
【题目】氢气是一种新型的绿色能源,又是一种重要的化工原料。以生物材质 (以C 计)与水蒸气反应制取H2是种低耗能,高效率的制H2方法。该方法由气化炉制造H2和燃烧炉再生CaO两步构成。气化炉中涉及到的反应为:
I C(s)+H2O(g)![]() CO(g)+H2(g) K1;
CO(g)+H2(g) K1;
II CO(g)+H2O(g)![]() CO2(g)+H2(g) K2;
CO2(g)+H2(g) K2;
III CaO(s)+CO2(g)![]() CaCO3(s) K3;
CaCO3(s) K3;
燃烧炉中涉及到的反应为:
IV C(s)+O2(g)=CO2
V CaCO3(s)=CaO(s)+CO2(g)
(1)该工艺制H2总反应可表示为C(s)+2H2O(g)+CaO(s) ![]() CaCO3(s)+2H2(g),其反应的平衡常数K=__________(用K1、K2、K3的代数式表示)。在2L的密闭容器中加入一定量的C(s)、H2O(g)和CaO(s)。下列能说明反应达到平衡的是_______________________。
CaCO3(s)+2H2(g),其反应的平衡常数K=__________(用K1、K2、K3的代数式表示)。在2L的密闭容器中加入一定量的C(s)、H2O(g)和CaO(s)。下列能说明反应达到平衡的是_______________________。
A.容器内压强不再变化 B. H2与H2O(g)的物质的量之比不再变化
C.混合气体的密度不再变化 D.形成a molH-H键的同时断裂2amolH-O键
(2)对于反应I,不同温度和压强对H2产率影响如下表。
温度 | 压强p1/Mpa | 压强p2/Mpa |
500℃ | 45.6% | 51.3% |
700℃ | 67.8% | 71.6% |
下列图像正确的是__________________。

(3)已知反应Ⅱ的ΔH=-41.1kJ/mol,C=O、O-H、H-H的键能分别为 803 kJ/mol,464 kJ/mol、436 kJ/mol,则CO中碳氧键的键能为___________ kJ/mol。
(4)对于反应Ⅲ,若平衡时再充入CO2,使其浓度增大到原来的2倍,则平衡移动方向为___________;当重新平衡后,CO2浓度___________(填“变大”“ 变小”“ 不变”)。
(5)甲醇燃料电池是采用铂作电极催化剂,其工作原理的示意图如下:

请回答下列问题:
①Pt(a)电极是电池的_______极,电极反应式为______________________;
②常温下,用此电池以惰性电极电解0.5L饱和食盐水(足量),若两极共生成气体1.12L(已折算为标准状况下的体积),则电解后溶液的pH=_________(忽略溶液的体积变化)。
【答案】 K1·K2·K3 BC BD 1072.9 正向移动或向右移动 不变 负 CH3OH-6e-+H2O=CO2+6H+ 13
【解析】(1)已知:① C(s)+H2O(g)![]() CO(g)+H2(g) K1;
CO(g)+H2(g) K1;
② CO(g)+H2O(g)![]() CO2(g)+H2(g) K2;
CO2(g)+H2(g) K2;
③ CaO(s)+CO2(g)![]() CaCO3(s) K3;
CaCO3(s) K3;
根据盖斯定律可知①+②+③即得到制H2总反应C(s)+2H2O(g)+CaO(s)![]() CaCO3(s)+2H2(g),所以该反应的平衡常数K=K1·K2·K3。A.反应前后体积不变,容器内压强不再变化不能说明反应达到平衡状态,A错误;B. 由于只有两种气体,因此H2与H2O(g)的物质的量之比不再变化说明正逆反应速率相等,达到平衡状态,B正确;C.密度是混合气的质量和容器容积的比值,在反应过程中容积始终是不变的,但气体的质量是变化的,因此混合气体的密度不再变化说明达到平衡状态,C正确;D.形成a molH-H键的同时断裂2amolH-O键均表示正反应速率,不能说明反应达到平衡状态,D错误,答案选BC;(2)压强相同时升高温度氢气的产率增加,说明正反应是吸热反应;温度相同时,增大压强平衡向逆反应方向进行,氢气产率降低,所以压强是P1>P2,则A、降低压强时平衡向正反应方向进行,正反应速率大于逆反应速率,A错误;B、升高温度平衡向正反应方向进行,氢气产率增大,B正确;C、温度相同时增大压强平衡向逆反应方向进行,水蒸气含量增大,C错误;D、升高温度平衡向正反应方向进行,平衡常数增大,D正确,答案选BD;(3)反应热等于断键吸收的能量和形成化学键所放出的能量的差值,已知反应Ⅱ的ΔH=-41.1kJ/mol,则x+2×464-2×803-436=-41.1,解得x=1072.9,即CO中碳氧键的键能为1072.9kJ/mol。(4)对于反应Ⅲ,若平衡时再充入CO2,使其浓度增大到原来的2倍,则平衡向正反应方向移动;由于该反应的平衡常数K=c(CO2),温度不变,平衡常数不变,所以当重新平衡后,CO2浓度不变。(5)①Pt(a)电极充入甲醇,产生CO2,所以是电池的负极,由于存在质子交换膜,则负极电极反应式为 CH3OH-6e-+H2O=CO2+6H+;②惰性电极电解饱和食盐水两电极分别产生氢气和氯气,且二者的物质的量相等,均是0.56L÷22.4L/mol=0.025mol,所以生成氢氧化钠是0.05mol,氢氧根的浓度是0.05mol÷0.5L=0.1mol/L,则电解后溶液的pH=13。
CaCO3(s)+2H2(g),所以该反应的平衡常数K=K1·K2·K3。A.反应前后体积不变,容器内压强不再变化不能说明反应达到平衡状态,A错误;B. 由于只有两种气体,因此H2与H2O(g)的物质的量之比不再变化说明正逆反应速率相等,达到平衡状态,B正确;C.密度是混合气的质量和容器容积的比值,在反应过程中容积始终是不变的,但气体的质量是变化的,因此混合气体的密度不再变化说明达到平衡状态,C正确;D.形成a molH-H键的同时断裂2amolH-O键均表示正反应速率,不能说明反应达到平衡状态,D错误,答案选BC;(2)压强相同时升高温度氢气的产率增加,说明正反应是吸热反应;温度相同时,增大压强平衡向逆反应方向进行,氢气产率降低,所以压强是P1>P2,则A、降低压强时平衡向正反应方向进行,正反应速率大于逆反应速率,A错误;B、升高温度平衡向正反应方向进行,氢气产率增大,B正确;C、温度相同时增大压强平衡向逆反应方向进行,水蒸气含量增大,C错误;D、升高温度平衡向正反应方向进行,平衡常数增大,D正确,答案选BD;(3)反应热等于断键吸收的能量和形成化学键所放出的能量的差值,已知反应Ⅱ的ΔH=-41.1kJ/mol,则x+2×464-2×803-436=-41.1,解得x=1072.9,即CO中碳氧键的键能为1072.9kJ/mol。(4)对于反应Ⅲ,若平衡时再充入CO2,使其浓度增大到原来的2倍,则平衡向正反应方向移动;由于该反应的平衡常数K=c(CO2),温度不变,平衡常数不变,所以当重新平衡后,CO2浓度不变。(5)①Pt(a)电极充入甲醇,产生CO2,所以是电池的负极,由于存在质子交换膜,则负极电极反应式为 CH3OH-6e-+H2O=CO2+6H+;②惰性电极电解饱和食盐水两电极分别产生氢气和氯气,且二者的物质的量相等,均是0.56L÷22.4L/mol=0.025mol,所以生成氢氧化钠是0.05mol,氢氧根的浓度是0.05mol÷0.5L=0.1mol/L,则电解后溶液的pH=13。


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:
【题目】断开1 mol AB(g)分子中的化学键使其分别生成气态A原子和气态B原子所吸收的能量称为A—B键的键能。下表列出了一些化学键的键能E:
化学键 | H—H | Cl—Cl | O===O | C—Cl | C—H | O—H | H—Cl |
E/kJ·mol-1 | 436 | 247 | x | 330 | 413 | 463 | 431 |
请回答下列问题:
(1)如图表示某反应的能量变化关系,则此反应为 (填“吸热”或“放热”)反应,其中ΔH=
(用含有a、b的关系式表示)。
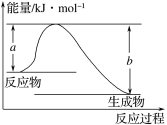
(2)若图示中表示反应H2(g)+![]() O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1,则b= kJ·mol-1,x= 。
O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1,则b= kJ·mol-1,x= 。
(3)历史上曾用“地康法”制氯气,这一方法是用CuCl2作催化剂,在450 ℃利用空气中的氧气跟氯化氢反应制氯气。反应的化学方程式为 。若忽略温度和压强对反应热的影响,根据上题中的有关数据,计算当反应中有1 mol电子转移时,反应的热量变化为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、Q、R是元素周期表前四周期元素,且原子序数依次增大,其相关信息如下表:
元素 | 相关信息 |
X | 原子核外有6种不同运动状态的电子 |
Y | 基态原子中s电子总数与p电子总数相等 |
Z | 原子半径在同周期元素中最大 |
M | 逐级电离能(kJ·mol-1)依次为 578、1817、2745、11575、14830、18376 |
Q | 基态原子的最外层p轨道上有两个电子的自旋方向与其他电子的自旋方向相反 |
R | 基态原子核外有7个能级且能量最高的能级上有6个电子 |
请用化学用语填空:
(1)X元素位于元素周期表第____周期____族; R是________区的元素。
(2)请写出Q元素基态原子的外围电子排布图____。
(3)X、Y、Z、M四种元素的原子半径由小到大的顺序是________。(用元素符号表示)
(4)R元素可形成R2+和R3+,其中较稳定的是R3+,原因是________。
(5)含Z元素的焰火显黄色,主要与________有关。
(6)M元素原子的逐级电离能越来越大的原因是________。
(7)与M元素成“对角线规则”关系的某短周期元素T的最髙价氧化物的水化物具有两性,写出该两性物质与Z元素的最高价氧化物的水化物反应的化学方程式:________;己知T元素和Q元素的电负性分别为1.5和3.0,则它们形成的化合物是________。(填“离子化合物”或“共价化合物”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】长期食用增塑剂超标的食品会对人体健康产生较大影响。邻苯二甲酸二丁酯(C16H22O4)是一种常见的增塑剂,它属于( )
A. 单质 B. 氧化物 C. 有机物 D. 无机物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,纵轴表示导电能力,横轴表示所加溶液的量,下列说法正确的是( )

A. 曲线A表示NaOH溶液中滴加稀盐酸
B. 曲线B表示CH3COOH溶液中滴加KOH溶液
C. 曲线C表示Ba(OH)2溶液中滴加稀硫酸
D. 曲线D表示Cu(OH)2悬浊液中滴加HNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏德罗常数,下列叙述正确的是( )
A. 标准状况下,22.4L H2O含有的分子数为 NA
B. 通常状况下,NA 个CO2分子占有的体积为22.4L
C. 物质的量浓度为1mol/L的MgCl2溶液中,含有Cl—个数为2NA
D. 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,互为同素异形体的是
A.O2和O3B.CH3CH3和CH2=CH2
C.146C和136CD.CH3CH2CH3和CH3CH(CH2CH3)CH2CH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com