
【题目】室温下,向100mL饱和的H2S溶液中通入SO2气体(气体体积换算成标准状况),发生反应:2H2S+SO2=3S↓+2H2O,测得溶液pH与通入SO2的关系如图所示。下列有关说法正确的是
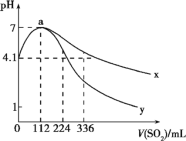
A.整个过程中,水的电离程度逐渐增大
B.该温度下H2S的Ka1数量级为10-7
C.曲线y代表继续通入SO2气体后溶液pH的变化
D.a点之后,随SO2气体的通入,![]() 的值始终减小
的值始终减小
【答案】C
【解析】
A.由图可知,a点表示SO2气体通入112mL即0.005mol时pH=7,溶液呈中性,说明SO2气体与H2S溶液恰好完全反应,可知饱和H2S溶液中溶质物质的量为0.01mol,c(H2S)=0.1mol/L,a点之前为H2S过量,a点之后为SO2过量,溶液均呈酸性,酸抑制水的电离,故a点水的电离程度最大,水的电离程度先增大后减小,故A错误;
B.由图中起点可知0.1mol/LH2S溶液电离出的c(H+)=10-4.1mol/L,电离方程式为H2SH++HS-、HS-H++S2-;以第一步为主,根据平衡常数表达式算出该温度下H2S的Ka1≈![]() ≈10-7.2,数量级为10-8,故B错误;
≈10-7.2,数量级为10-8,故B错误;
C.当SO2气体通入336mL时,相当于溶液中的c(H2SO3)=0.1mol/L,因为H2SO3酸性强于H2S,故此时溶液中对应的pH应小于4.1,故曲线y代表继续通入SO2气体后溶液pH的变化,故C正确;
D.根据平衡常数表达式可知![]() ,a点之后,随SO2气体的通入,c(H+)增大,当通入的SO2气体达饱和时,c(H+)就不变了,Ka1也是一个定值,
,a点之后,随SO2气体的通入,c(H+)增大,当通入的SO2气体达饱和时,c(H+)就不变了,Ka1也是一个定值,![]() 的值保持不变,故D错误;
的值保持不变,故D错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】利用废旧镀锌铁皮可制备磁性Fe3O4胶体粒子及副产物ZnO,制备流程如下图所示:
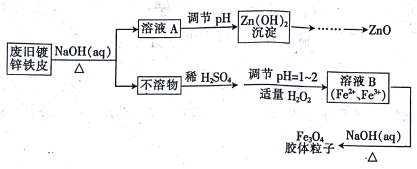
(1)从流程图可知,Zn、Fe中能与NaOH溶液反应的是________。
(2)Zn(OH)2沉淀加热可得ZnO,该反应______(填“是”或“不是”)氧化还原反应。
(3)向不溶物中加入稀H2SO4发生反应的离子方程式是_________。
(4)加入适量H2O2的目的是_________。
(5)如何证明已生成了Fe3O4胶体? _________。
(6)流程中所需的硫酸溶液由焦硫酸(H2SO4·SO3)溶于水配制而成,其中的SO3都转化为硫酸,若将445g焦硫酸溶于水配成4.00L 硫酸,该硫酸的物质的量浓度为__mol/L
(7)稀硫酸也可以用浓硫酸和水配制。已知4mol/L的硫酸溶液密度为ρ1 g/cm3,2mol/L的硫酸溶液密度为ρ2 g/cm3。100g物质的量浓度为4mol/L 的硫酸溶液与___mL水混合,使硫酸的物质的量浓度减小到2mol/L。(用含ρ1、ρ2的式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积恒定的密闭容器中,进行如下可逆反应:A(s)+B(g)![]() 2C(g),当下列物理量不发生变化时,能表明该反应已达到平衡状态的是( )
2C(g),当下列物理量不发生变化时,能表明该反应已达到平衡状态的是( )
①混合气体的密度 ②容器内气体的压强 ③混合气体的总物质的量 ④B物质的量浓度
A. ①②④ B. ②③ C. ②③④ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锆石(ZrSiO4)酷似钻石且价格低廉,是钻石很好的代用品。天然锆石的主要成分是ZrSiO4,另外还常含有Fe、Al、Cu的氧化物杂质。工业上以天然锆石为原料制备ZrO2的工艺流程如下:
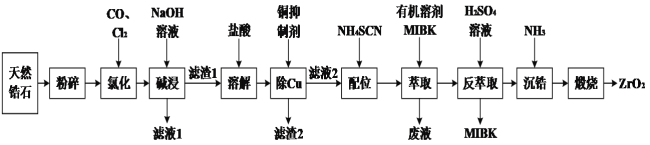
已知:i.氯化过程中除C、O外,其他元素均转化为其最高价氯化物;
ⅱ.Zr在化合物中通常显+4价;ZrC14易溶于水,400 ℃时升华;
ⅲ.“配合”生成的Fe(SCN)3难溶于MIBK,Zr(SCN)4在水中的溶解度小于在MIBK中的溶解度。
(1)将锆石“粉碎”的目的是_______________________________。
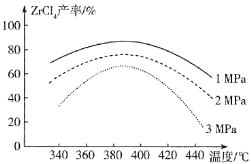
(2)“氯化”过程中,ZrSiO4发生反应的化学方程式为_______________,由下图可知,“氯化”过程选择的最佳反应条件是_________ ;若“氯化”温度过高会导致ZrC14产率降低,原因是________。
(3)常用的铜抑制剂为NaCN,它可与重金属离子生成沉淀,如Cu(CN)2,其Ksp=4.0×10-10。已知盐酸溶解后的溶液中Cu2+的浓度为1mol·L-1,若溶液中Cu2+的浓度小于等于1.0×10-6mol·L-1时可视为沉淀完全,则Cu2+沉淀完全时溶液中CN-的浓度为________molL-1。
(4)由于NaCN有剧毒,所以需要对“废液”中的NaCN进行处理,通常选用漂白液(有效成分是NaClO)在碱性条件下将其氧化,其产物之一是空气中的主要成分,则上述反应的离子方程式为___________。
(5)流程中“萃取”与“反萃取”可以分离铁、富集锆,简述“萃取”的原理:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg(OH)2是常用的阻燃材料。以白云石(CaCO3、MgCO3的混合物)为原料制备Mg(OH)2和CaCO3的工艺流程如下:
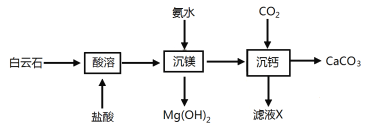
下列说法不正确的是
A.酸溶生成Mg2+的离子方程式是:MgCO3+2H+= Mg2++CO2↑+H2O
B.流程中可以循环利用的物质是CO2
C.酸溶过程中盐酸可用稀硝酸或硫酸代替
D.流程中没有涉及氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不具有因果关系的是( )
A. 明矾溶于水后生成氢氧化铝胶体,因此具有净水能力
B. 纯碱水溶液呈碱性,因此可以去油污
C. 二氧化硅与氢氧化钠溶液反应生成硅酸钠,因此装氢氧化钠溶液的试剂瓶不能用玻璃塞
D. ![]() 具有漂白性,因此能使酸性高锰酸钾溶液褪色
具有漂白性,因此能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分类法在化学学习中起到了重要的作用。已知下列物质:①NaOH溶液、②NO2、③Fe(OH)3、④熔融NaCl、⑤SO2、⑥氨水。回答下列相关问题:
(1)属于混合物的有______________________(填序号,下同)。
(2)属于电解质的有_________________。
(3)能导电的有_____________________。
(4)实验室制备少量Fe(OH)3胶体的离子方程式是_____。
(5)实验室用NaOH溶液吸收NO2的化学方程式为2NO+2NaOH=NaNO2+ NaNO3+H2O,则该反应中氧化剂与还原剂的物质的量之比为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组数据中,前者刚好是后者两倍的是 ( )
A. 2 mol H2O的摩尔质量和1 mol H2O的摩尔质量
B. 200 mL 1 mol·L-1氯化钙溶液中c(Cl-)和100 mL 2 mol·L-1氯化钾溶液中c(Cl-)
C. 64 g二氧化硫中氧原子数和标准状况下22.4 L一氧化碳中氧原子数
D. 20% NaOH溶液中NaOH的物质的量浓度和10% NaOH溶液中NaOH的物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼烯是继石墨烯之后又一种“神奇纳米材料”,具有优良的导电、导热性能。科学家已成功合成多种结构的硼烯,如图为“皱褶”式硼烯的结构,下列说法正确的是

A.“皱褶”式硼烯中含B、H 两种元素
B.“皱褶”式硼烯中硼原子达到8电子稳定结构
C.硼的最高价氧化物对应水化物的酸性比碳酸的强
D.硼烯有望代替石墨烯作锂离子电池的电极材料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com