
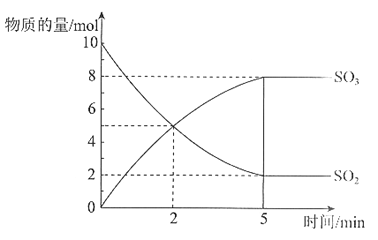
【题目】在2 L的密闭容器中,SO2和O2在催化剂500℃的条件下发生反应。SO2和SO3的物质的量随时间变化的关系曲线如图所示。
回答下列问题。
(1)该反应的化学方程式是_________。
(2)在前2 min内,以SO2的浓度变化表示的速率是_________mol/(L·min)。
(3)反应达到平衡状态的依据是_________。
a. 单位时间内消耗1 mol SO2,同时生成1 mol SO3
b. SO2的浓度与SO3浓度均不再变化
c. SO2的浓度与SO3浓度相等
【答案】2SO2+O2 ![]() 2SO31.25b
2SO31.25b
【解析】
(1)SO2和O2在催化剂500℃的条件下发生反应生成SO3。该反应的化学方程式是2SO2+O2 ![]() 2SO3;
2SO3;
(2)根据曲线图可知,在前2 min内,以SO2的浓度变化表示的速率是![]() =1.25mol/(L·min);
=1.25mol/(L·min);
(3)可逆反应达到化学平衡状态的标志是正、逆反应速率相等、各组分浓度保持不变。a. 单位时间内消耗1 mol SO2,同时生成1 mol SO3,均为正反应,不能体现v(正)=v(逆),不是平衡状态;b. SO2的浓度与SO3浓度均不再变化,各组分浓度保持不变,说明反应达到平衡状态;c. SO2的浓度与SO3浓度相等为特殊情况,不能说明v(正)=v(逆),不是平衡状态;答案选b。


科目:高中化学 来源: 题型:
【题目】
降凝剂是指能降低润滑油凝固点的化学品,一般是高分子有机化合物,降凝剂I是两种物质加聚得到的高分子化合物,通常加入油品中以降低凝固点,扩大燃料油品的使用范围,为合成得到降凝剂I,设计了以烯烃A为起始原料的合成路线:

试写出:
(1) A的名称:________________,B→C的反应条件:____________________。
F中含有的官能团名称:______________________。
(2) E可以在一定条件下合成高聚物J,写出反应的化学方程式:_______________________。
(3) H是一种核磁共振氢谱一组峰的五元环状结构,写出降凝剂I的结构简式:____________。
(4) F有多种同分异构体,其中①能与NaOH溶液反应但不能与NaHCO3溶液反应②能使溴水褪色的同分异构体有______种(不考虑顺反异构),写出其中核磁共振氢谱峰面积之为1∶1∶2∶2与NaOH溶液反应的化学方程式:____________________________________。
(5) 请结合合成路线写出由苯乙醇、乙醇为原料合成 的最合理方案。___________________ (其他无机试剂任选)
的最合理方案。___________________ (其他无机试剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据反应:2FeCl3 + 2KI = 2FeCl2 + 2KCl + I2;2FeCl2 + Cl2 = 2FeCl3。判断下列物质的氧化性由强到弱的顺序是( )
A.Cl2>Fe3+>I2 B.Fe3+>Cl2>I2 C.Fe3+>I2>Cl2 D. Cl2>I2> Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. c(NH4+)相等的NH4Fe(SO4)2溶液、NH4HCO3溶液、(NH4)2SO4溶液,溶质浓度大小关系是:c[(NH4)2SO4] <c[NH4HCO3] <c[NH4Fe(SO4)2]
B. 常温下下,0.1mol/LHC1溶液与等体积0.1mol/LBa(OH)2溶液混合后,溶液的pH=13
C. 0.lmol/L的NaHCO3 溶液中,c(H+)+c(H2CO3)=c(CO32-)+c(OH- )
D. 用惰性电极电解饱和氯化钠溶液: 2C1-+2H+![]() H2↑+ Cl2↑
H2↑+ Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】—定温度下,将2 mol SO2和1mol O2充入10 L恒容密闭容器中,发生反应2SO2(g) +O2(g)![]() 2SO3(g) △H =-196 kJ mol-1。5 min时达到平衡,测得反应放热166. 6 kJ。下列说法错误的是
2SO3(g) △H =-196 kJ mol-1。5 min时达到平衡,测得反应放热166. 6 kJ。下列说法错误的是
A. 0~5 min内,用O2表示的平均反应速率V(O2)=0.017 mol·L-1·min-1
B. ![]() 的值不变时,该反应达到平衡状态
的值不变时,该反应达到平衡状态
C. 若增大O2的浓度,SO2的转化率增大
D. 条件不变,若起始时充入4 mol SO2和2 mol O2,平衡时放出的热量小于333.2 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质混合后,不能生成NaOH的是
A.Na和H2OB.Na2O2和H2O
C.Ca(OH)2溶液和NaCl溶液D.Ca(OH)2溶液和Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业以黄铜矿(主要成分是CuFeS2)为原料制备粗铜,进一步以粗铜为原料制备CuSO4·5H2O晶体。工艺流程如下(部分操作和条件略):
I. 煅烧黄铜矿,得到粗铜(含铁及铁、铜的化合物等);
II. 向粗铜中加入稀H2SO4和稀HNO3,并使产生的NO与H2O、O2反应;
III. 调节Ⅱ中所得溶液的pH,过滤;
Ⅳ. 将Ⅲ中滤液浓缩后冷却结晶,过滤,得到CuSO4·5H2O晶体。
已知:生成氢氧化物的pH
Cu(OH)2 | Fe(OH)3 | |
开始沉淀时 | 4.8 | 1.5 |
完全沉淀时 | 6.7 | 2.8 |
注:金属离子的起始浓度为0.1 mol/L
请回答:
(1)I中主要发生如下两个化学反应。请将反应ii的化学方程式补充完整。
i. 2CuFeS2+4O2![]() Cu2S+3SO2+2FeO
Cu2S+3SO2+2FeO
ii. ![]() Cu2S+
Cu2S+![]() O2
O2 ![]()
![]() _________+
_________+ ![]() SO2
SO2
(2)II中NO与H2O、O2反应的化学方程式是_________。
(3)III中的滤渣主要是Fe(OH)3。调节溶液的pH时,pH范围是_________。
(4)有关上述过程的说法中,正确的是_________(填序号)。
a. I中尾气含有SO2,可综合利用制备H2SO4。
b. II中稀HNO3的作用之一是使Cu单质转化为Cu2+
c. 在上述过程中,HNO3可循环利用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com