
【题目】实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH![]() +6HCHO=3H++6H2O+(CH2)6N4H+[滴定时,1mol(CH2)6N4H+与1molH+相当],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
+6HCHO=3H++6H2O+(CH2)6N4H+[滴定时,1mol(CH2)6N4H+与1molH+相当],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤Ⅰ:称取样品1.500g。
步骤Ⅱ:将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀。
步骤Ⅲ:移取25.00mL样品溶液于250mL锥形瓶中,加入10mL20%的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点.按上述操作方法再重复2次。
(1)根据步骤Ⅲ填空:
①滴定时边滴边摇动锥形瓶,眼睛应观察___。
②达到滴定终点的标志是___。
③以下操作造成测得样品中氮的质量分数偏高的原因可能是___。
A.配制标准溶液的氢氧化钠中混有Na2CO3杂质
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,水未倒尽
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E.未用标准液润洗碱式滴定管
(2)滴定结果如下表所示:
滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
滴定前刻度/mL | 滴定后刻度/mL | ||
1 | 25.00 | 1.02 | 21.03 |
2 | 25.00 | 2.00 | 21.99 |
3 | 25.00 | 0.20 | 20.20 |
若NaOH标准溶液的浓度为0.1010mol/L,则该样品中氮的质量分数为__。
【答案】锥形瓶内溶液颜色的变化 锥形瓶内溶液颜色变浅红色且半分钟不变化 A、D、E 18.85%
【解析】
(1)①根据中和滴定操作规范,滴定时边滴边摇动锥形瓶,眼睛应观察锥形瓶内溶液颜色的变化;
②待测液呈酸性,滴入酚酞试液呈无色,滴加氢氧化钠过程中pH增大,达到滴定终点的标志是锥形瓶内溶液颜色由无色变浅红色且半分钟不变化;
③A.配制标准溶液的氢氧化钠中混有Na2CO3杂质,氢氧化钠溶液浓度偏低,消耗氢氧化钠溶液的体积偏大,测定结果偏高;
B.滴定终点读数时,俯视滴定管的刻度,消耗氢氧化钠溶液体积偏小,测定结果偏低;
C.盛装未知液的锥形瓶用蒸馏水洗过,水未倒尽,无影响;
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液,消耗氢氧化钠溶液体积偏大,测定结果偏高;
E.未用标准液润洗碱式滴定管,氢氧化钠浓度偏低,消耗氢氧化钠溶液体积偏大,测定结果偏高;
故选A、D、E;
(2)根据表格数据,三次平均消耗氢氧化钠溶液的体积为20.00 mL,消耗氢氧化钠的物质的量是0.02L×0.1010mol/L=0.00202mol,根据方程式4NH![]() +6HCHO=3H++6H2O+(CH2)6N4H+[滴定时,1mol(CH2)6N4H+与1molH+相当],25 mL待测液中N原子的物质的量是0.00202mol,则该样品中氮的质量分数为
+6HCHO=3H++6H2O+(CH2)6N4H+[滴定时,1mol(CH2)6N4H+与1molH+相当],25 mL待测液中N原子的物质的量是0.00202mol,则该样品中氮的质量分数为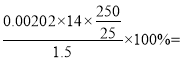 18.85% ;
18.85% ;


科目:高中化学 来源: 题型:
【题目】A~E是中学常见的5种化合物,A、B是氧化物,它们之间的转化关系如下图所示。则下列说法正确的是( )

A. X与A反应的化学方程式是:Al2O3 + 2Fe ![]() Fe2O3 + 2Al
Fe2O3 + 2Al
B. 检验D溶液中的金属阳离子的反应:Fe3++3SCN—= Fe(SCN)3↓
C. 单质Y在一定条件下能与水发生置换反应
D. 由于化合物B和C均既能与酸反应,又能与碱反应,所以均是两性化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列物质:
①KCl ②CH4 ③NH4NO3 ④I2 ⑤Na2O2 ⑥HClO4 ⑦N2 ⑧CO ⑨SO2 ⑩金刚石 CH3CH2OH MgO MgCl2 KOH HCl Al2O3
请回答下列问题。
(1)两性氧化物是___(填序号),其电子式为___。
(2)最简单的有机化合物是___(填序号),用电子式表示其形成过程:___。
(3)属于共价化合物的是___(填序号),含有共价键的离子化合物是___(填序号)。
(4)由两种元素组成,且含有离子键和共价键的化合物为___(填序号),这两种元素的单质反应生成该化合物的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟他胺G是一种可用于治疗肿瘤的药物。实验室由芳香烃A制备G的合成路线如下:
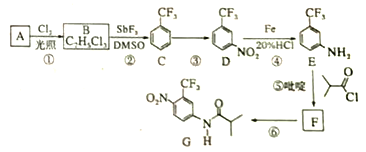
回答下列问题:
(1)A的结构简式为_______________。C的化学名称是________________________。
(2)③的反应试剂和反应条件分别是______________________,该反应的类型是___________。
(3)⑤的反应方程式为_____________________________________________。
吡啶是一种有机碱,其作用是______________________________。
(4)G的分子式为______________________________。
(5)H是G的同分异构体,其苯环上的取代基与G的相同但位置不同,则Ⅱ可能的结构有_________种。
(6)4-甲氧基乙酰苯胺(![]() )是重要的精细化工中间体,写出由苯甲醚(
)是重要的精细化工中间体,写出由苯甲醚(![]() )制备小甲氧基乙酸苯胺的合成路线(其他试剂任选)_______________。
)制备小甲氧基乙酸苯胺的合成路线(其他试剂任选)_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用NO、O2和Na2CO3溶液反应制备NaNO2的装置如图所示,下列关于该装置的描述不正确的是( )
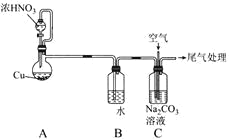
A.装置A分液漏斗中的药品选用不当,应选用稀HNO3
B.实验过程中,通过控制分液漏斗的活塞控制气流速度
C.装置C中发生反应的化学方程式为2Na2CO3+4NO+O2=4NaNO2+2CO2↑
D.实验过程中,装置C液面上方可能出现红棕色气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,只改变反应物中n(SO2)对反应2SO2(g)+O2(g)2SO3(g)的影响如图所示,下列说法正确的是( )
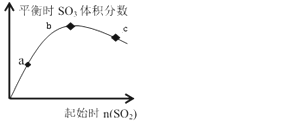
A. 反应a、b、c点均为平衡点,且b点时SO2的转化率最高
B. b点时SO2与O2 的物质的之比约为2:1
C. a、b、c 三点平衡常数: Kb>Kc>Ka
D. a、b、c 三点反应速率大小为: vb>vc>va
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 2CH3OH(g)![]() C2H4(g)+2H2O(g)。 某研究小组将甲醇蒸气以一定的流速持续通过相同量的同种催化剂, 不同温度得到如下图像, 则下列结论不正确的是
C2H4(g)+2H2O(g)。 某研究小组将甲醇蒸气以一定的流速持续通过相同量的同种催化剂, 不同温度得到如下图像, 则下列结论不正确的是
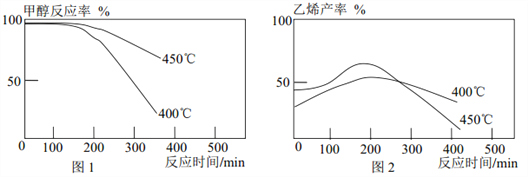
A. 一段时间后甲醇反应率下降可能是催化剂活性下降
B. 综合图 1、 图 2 可知, 甲醇还发生了其他反应
C. 若改变甲醇蒸气的流速, 不会影响甲醇反应率和乙烯产率
D. 制乙烯比较适宜的温度是 450℃左右
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着我国对环境问题的重视,碳、氮及其化合物的研究备受关注。
已知:Ⅰ![]()
![]() ;
;
Ⅱ![]()
![]() ;
;
Ⅲ![]()
![]()
![]() .
.
请回答下列问题:
(1)![]() ________。
________。
(2)一定温度下,向刚性容器中充入![]() 和足量
和足量![]() ,发生上述反应,部分物质的物质的量浓度随时间的变化情况如图所示。
,发生上述反应,部分物质的物质的量浓度随时间的变化情况如图所示。
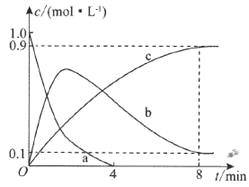
![]() 已知曲线a代表
已知曲线a代表![]() 的浓度变化,曲线b代表NO的浓度变化,则曲线c代表________的浓度变化。
的浓度变化,曲线b代表NO的浓度变化,则曲线c代表________的浓度变化。
![]() 该刚性容器的容积为________;
该刚性容器的容积为________;![]() 内,
内,![]() 的消耗速率
的消耗速率![]() ________。
________。
![]() 该条件下,反应Ⅰ和反应Ⅱ中活化能较大的是________
该条件下,反应Ⅰ和反应Ⅱ中活化能较大的是________![]() 填“反应Ⅰ”或“反应Ⅱ”
填“反应Ⅰ”或“反应Ⅱ”![]() ,原因为________。
,原因为________。
![]() 该温度下,反应Ⅲ的化学平衡常数
该温度下,反应Ⅲ的化学平衡常数![]() Ⅲ
Ⅲ![]() ________。
________。
(3)若其他条件不变,将恒温容器改为绝热容器,再次达到平衡后,与原平衡相比,CO的体积分数________![]() 填“增大”“减小”或“不变”
填“增大”“减小”或“不变”![]() ,原因为________。
,原因为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化白藜芦醇W具有抗病毒等作用。下面是利用Heck反应合成W的一种方法:
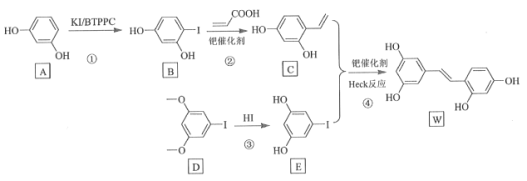
回答下列问题:
![]() 的化学名称为___________。
的化学名称为___________。
![]()
![]() 中的官能团名称是___________。
中的官能团名称是___________。
![]() 反应③的类型为___________,W的分子式为___________。
反应③的类型为___________,W的分子式为___________。
![]() 不同条件对反应④产率的影响见下表:
不同条件对反应④产率的影响见下表:
实验 | 碱 | 溶剂 | 催化剂 | 产率 |
1 | KOH | DMF |
|
|
2 |
| DMF |
|
|
3 |
| DMF |
|
|
4 | 六氢吡啶 | DMF |
|
|
5 | 六氢吡啶 | DMA |
|
|
6 | 六氢吡啶 | NMP |
|
|
上述实验探究了________和________对反应产率的影响。此外,还可以进一步探究________等对反应产率的影响。
![]() 为D的同分异构体,写出满足如下条件的X的结构简式________________。
为D的同分异构体,写出满足如下条件的X的结构简式________________。
含有苯环;②有三种不同化学环境的氢,个数比为6:2:1;③1 mol的X与足量金属Na反应可生成2 g H2。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com