
����Ŀ�������ܿ�����ָʾ���ʹ������Ʊ�����ˮ�ܿ�(��Ҫ�ɷ�ΪCo2O3��������Fe2O3��Al2O3��MnO��MgO��CaO��SiO2��)��ȡCoC2O4��2H2O������������ͼ��ʾ��
��֪���ٽ���Һ���е���������Ҫ��H����Co2+��Fe2+��Mn2+��Ca2+��Mg2+��Al3+�ȣ�
�����������£�ClO3-��������Co2+��ClO3-ת��ΪCl-��
�۲���������������������ʽ����ʱ��Һ��pH���±���
������ | Fe(OH)3 | Al(OH)3 | Co(OH)2 | Fe(OH)2 | Mn(OH)2 |
��ȫ������pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.8 |
(1)���������м���Na2SO3����ҪĿ����_______________________��
(2)�����Һ�м���NaClO3�����ӷ�Ӧ����ʽ��_____________________��
(3)��֪��������NH3��H2O![]() NH4++OH-��Kb=1.8��10-5
NH4++OH-��Kb=1.8��10-5
H2C2O4![]() H��+HC2O4-��Ka1=5.4��10-2
H��+HC2O4-��Ka1=5.4��10-2
HC2O4-![]() H��+C2O42-��Ka2=5.4��10-5
H��+C2O42-��Ka2=5.4��10-5
�������������(NH4)2C2O4��Һ��pH____7 (����>������<������=��)��
(4)����(NH4)2C2O4��Һ���������壬�ٹ��ˡ�ϴ�ӣ�ϴ��ʱ��ѡ�Լ�_____(����ĸ����)��
A.����ˮ B.����ˮ C.���͵�(NH4)2C2O4��Һ D.ϡ����
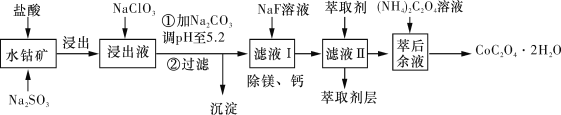
(5)��ȡ���Խ������ӵ���ȡ����pH�Ĺ�ϵ��ͼ��ʾ����ȡ���������dz�ȥ�����ӣ���ʹ�õ�����pH��Χ��_________(����ĸ����)��
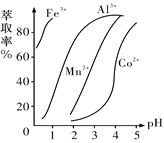
A.2.0��2.5�������� B.3.0��3.5 ������C.4.0��4.5
(6)CoC2O4��2H2O�ȷֽ������仯������ͼ��ʾ������600����ǰ�Ǹ����������ȣ�600���Ժ����ڿ����м��ȡ�A��B��C��Ϊ�����C����ʾ����Ļ�ѧʽ��_____________��
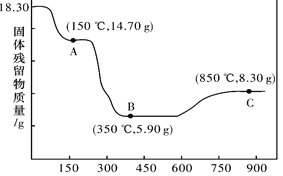
���𰸡���Co3+��ԭΪCo2+ ClO3-+6Fe2++6H+ =6Fe3++Cl-+3H2O < A B Co2O3
��������
���ܷ����м������ᣬ�ɵ�CoCl3��FeCl3��AlCl3��MnCl2��MgCl2��CaCl2����Ϣ���н���Һ���е���������Ҫ��H+��Co2+��Fe2+��Mn2+��Ca2+��Mg2+��Al3+�ȣ�������Na2SO3��Co3+��Fe3+��ԭΪCo2+��Fe2+�������������յõ������ܣ�����NaClO3��Fe2+����ΪFe3+������Na2CO3��pH��5.2���ɵõ�Fe(OH)3��Al(OH)3���������˺�������Һ��Ҫ����CoCl2��MnCl2��MgCl2��CaCl2����NaF��Һ��ȥ�ơ�þ�����˺�����Һ�м�����ȡ��������������ȡ����ȡ�����Һ����Ҫ����CoCl2������������Һ�õ������ܡ�
(1)Na2SO3��Co3+��Fe3+��ԭΪCo2+��Fe2+��
(2)NaClO3���������ԣ��ܽ�����Һ�е�Fe2+������Fe3+����������ԭ���������ӣ�ͬʱ����ˮ��
(3)���ݲ���Ķ���������ڰ�ˮ�ĵ��볣���Լ�����ˮ��Ĺ��ɷ�����
(4) (NH4)2C2O4Ϊ�������ĸ���Һ����Ҫ�Ծ������ϴ�ӣ�ϴ��ʱ�����������µ��������ӣ��ݴ˷����жϣ�
(5)��Һ�м�����ȡ���������dz�ȥ�����ӣ�pH=2��pH=3ʱCo2+����ȡ�ʱ仯����pH=3ʱMn����ȡ������ܶ࣬��pH=5ʱ��Co2+����ȡ�ʱȽϴ���ʧ���أ�
(6)��ͼ��֪��C��������������Ϊ8.30g������������Ԫ������Ϊ8.30g-5.9g=2.40g���ݴ�������������Coԭ����Oԭ�����ʵ���֮�ȣ�ȷ��Co�������ﻯѧʽ��
���ܷ����м������ᣬ�ɵ�CoCl3��FeCl3��AlCl3��MnCl2��MgCl2��CaCl2����Ϣ���н���Һ���е���������Ҫ��H+��Co2+��Fe2+��Mn2+��Ca2+��Mg2+��Al3+�ȣ�������Na2SO3��Co3+��Fe3+��ԭΪCo2+��Fe2+�������������յõ������ܣ�����NaClO3��Fe2+����ΪFe3+������Na2CO3��pH��5.2���ɵõ�Fe(OH)3��Al(OH)3���������˺�������Һ��Ҫ����CoCl2��MnCl2��MgCl2��CaCl2����NaF��Һ��ȥ�ơ�þ�����˺�����Һ�м�����ȡ��������������ȡ����ȡ�����Һ����Ҫ����CoCl2������������Һ�õ������ܡ�
(1)Na2SO3����ǿ�Ļ�ԭ�ԣ����������м���Na2SO3��Ŀ���ǽ�Co3+��Fe3+��ԭΪCo2+��Fe2+��
(2)NaClO3���������ԣ��ܽ�����Һ�е�Fe2+������Fe3+����������ԭ���������ӣ�ͬʱ����ˮ�����ӷ�Ӧ����ʽΪClO3-+6Fe2++6H+ =6Fe3++Cl-+3H2O��
(3)��������ˮ����ɣ�������ˮ�⣬˭��˭ˮ�⣬˭ǿ��˭�ԣ�NH3��H2O![]() NH4++OH-��Kb=1.8��10-5��H2C2O4
NH4++OH-��Kb=1.8��10-5��H2C2O4![]() H��+HC2O4-��Ka1=5.4��10-2 HC2O4-
H��+HC2O4-��Ka1=5.4��10-2 HC2O4-![]() H��+C2O42-��Ka2=5.4��10-5
H��+C2O42-��Ka2=5.4��10-5
����(NH4)2C2O4��Һ��笠�����ˮ����ڲ��������ˮ�⣬��Һ�����ԣ���pH<7��
(4)Ϊϴ�Ӿ��帽�ŵ����ӣ�ͬʱ�������µ��������ӣ����˻�þ���ϴ��ʱ����ֱ��ѡ������ˮϴ�ӣ��ʺ���ѡ����A��
(5)��Һ�м�����ȡ���������dz�ȥMn2+��pH=2��pH=3ʱCo2+����ȡ�ʱ仯����pH=3ʱMn2+����ȡ������ܶ࣬��pH=5ʱ��Co2+����ȡ�ʱȽϴ���ʧ���أ���pH=3ʱ��ѣ��ʺ���ѡ����B��
(6)��ͼ��֪��C��������������Ϊ8.30g��0.1molCoԪ������Ϊ5.9g������������Ԫ������Ϊ8.30g-5.9g=2.40g������������Coԭ����Oԭ�����ʵ���֮��Ϊ0.1mol��![]() ��2��3����C����ʾ��Co���ﻯѧʽΪCo2O3��
��2��3����C����ʾ��Co���ﻯѧʽΪCo2O3��


 ��ѧ�̸̳����¿α�ϵ�д�
��ѧ�̸̳����¿α�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ���ı�0.1mol��L��1H2SO3��Һ��pH�����������ʵ��������������仯��ͼ��ʾ������˵���д������
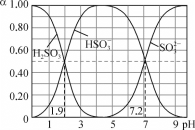
A. 1gK1��H2SO3������1.9
B. pH��3ʱ��c��HSO3������c��H2SO3����c��SO32����
C. ��ӦH2SO3��SO32��![]() 2HSO3����lgK��5.3
2HSO3����lgK��5.3
D. pH��7.2ʱ��c��HSO3������c��SO32������c��H����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Ӧ��H2(g)��![]() O2(g)=H2O(g) ��H1
O2(g)=H2O(g) ��H1
![]() N2(g)��O2(g)=NO2(g) ��H2
N2(g)��O2(g)=NO2(g) ��H2
![]() N2(g)��3/2H2(g)=NH3(g) ��H3
N2(g)��3/2H2(g)=NH3(g) ��H3
��Ӧ2NH3(g)��![]() O2(g)=2NO2(g)��3H2O(g)����HΪ�� ��
O2(g)=2NO2(g)��3H2O(g)����H�� ��
A. 2��H1��2��H2��2��H3B. ��H1����H2����H3
C. 3��H1��2��H2��2��H3D. 3��H1��2��H2��2��H3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��TKʱ��Ca(OH)2��CaWO4������ˮ��pCa����lgc(Ca2��)��pX����lgc(WO42-)��lgc(OH��)��TKʱCaWO4��Ca(OH)2�ij����ܽ�ƽ��������ͼ��ʾ��
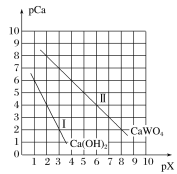
��1������Na2WO4��Һ�м��뱥��ʯ��ˮ������Ϊ__�����ӷ���ʽΪ��__��
��Na2WO4��Һ��ʯ�����ϣ������������CaWO4����÷�Ӧ��ƽ�ⳣ��K��__��
��2����֪Ksp(BaSO4)��1.1��10��10��Ksp(BaMoO4)��4.0��10��8�������ƾ���(Na2MoO4��2H2O)�����͵Ľ�����ʴ������������������Һ�������������������������ʣ��ɼ���Ba(OH)2�����ȥSO42-(��Һ����仯����)����BaMoO4��ʼ����ʱ����Һ�е�![]() ��__(�������2λ��Ч����)��
��__(�������2λ��Ч����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧϰС��Ϊ�о�ͭ��Ũ��ϡHNO3��Ӧ�IJ��죬�������ͼ��ʾ��ʵ��װ�á�
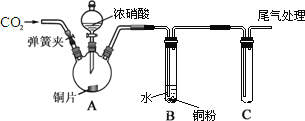
����˵������ȷ����
A. ��Ӧ��ʼǰͨ�������CO2���壬Ŀ�����ų�װ���ڵĿ���
B. A�е����ӷ���ʽΪ��Cu+2NO3-+4H+==Cu2++2NO2��+2H2O
C. ��B��0.03 molͭ�۱�����ʱ��B�в�����NO�������0.02 mol
D. Cװ����װ��һ������ˮ����β������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͼ����ʾ��װ��ͼ�ܹ��ﵽʵ��Ŀ����
A.����һ��Ũ�ȵ�NaOH��Һ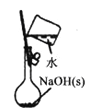
B.�к��ȵIJⶨ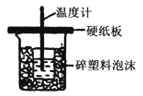
C.��������NaOH����
D.�ⶨ���������Һ��Ũ��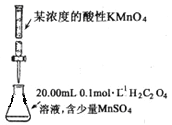
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ������˵������ȷ���ǣ� ��
A.��״���£�22.4 L���������к��еķ�����ΪNA
B.0.5 mol��L-1��Na2SO4��Һ�У�����Na���ĸ���ΪNA
C.��״���£�22.4L����������22.4L����������ԭ��������Ϊ2NA
D.32 g ������������ԭ����ĿΪ2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£���2mol![]() ��
��![]() ����10L�����ܱ������У�������Ӧ
����10L�����ܱ������У�������Ӧ![]() ��5minʱ�ﵽƽ�⣬��÷�Ӧ����
��5minʱ�ﵽƽ�⣬��÷�Ӧ����![]() ����˵���������
����˵���������![]()
A.![]() �ڣ���
�ڣ���![]() ��ʾ��ƽ����Ӧ����
��ʾ��ƽ����Ӧ����![]()
![]()
B.��Ӧ��Ũ�ȵı�ֵ����ʱ���÷�Ӧ�ﵽƽ��״̬
C.������![]() ��Ũ�ȣ�
��Ũ�ȣ�![]() ��ת��������
��ת��������
D.�������䣬����ʼʱ����4mol![]() ��
��![]() ��ƽ��ʱ�ų�����������
��ƽ��ʱ�ų�����������![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ںϳɲ��ϵ�˵���У��������
A.������ϩ���Ƴɱ�Ĥ�����ܵȣ��䵥����CH2=CHCl
B.����![]() �ĵ�����H2N(CH2)6NH2��HOOC(CH2)4COOH
�ĵ�����H2N(CH2)6NH2��HOOC(CH2)4COOH
C.�ϳɷ�ȩ��֬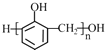 �ĵ����DZ��Ӻͼ״�
�ĵ����DZ��Ӻͼ״�
D.�ϳ�˳����![]() �ĵ�����CH2=CH��CH=CH2
�ĵ�����CH2=CH��CH=CH2
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com