
【题目】数十年来,化学工作者对碳的氧化物做了广泛深入的研究并取得了一些重要成果。如利用CO2和CH4重整可制合成气(主要成分为CO、H2),已知重整过程中部分反应的热化学方程式为:
I、CH4(g)=C(s)+2H2(g) △H=+75.0kJ·mol-1
II、CO2(g)+H2(g)=CO(g)+H2O(g) △H=+41.0kJ·mol-1
III、CO(g)+H2(g)=C(s)+H2O(g) △H=-131.0kJ·mol-1
(1)反应CO2(g)+CH4(g)=2CO(g)+2H2(g)的△H = kJ·mol-1。
(2)固定n(CO2)=n(CH4),改变反应温度,CO2和CH4的平衡转化率见图甲。


①同温度下CO2的平衡转化率 (填“大于”或“小于”)CH4的平衡转化率,其原因是 。
②高温下进行该反应时常会因反应I生成“积碳”(碳单质),造成催化剂中毒,高温下反应I能自发进行的原因是 。
(3)一定条件下Pd-Mg/SiO2催化剂可使CO2“甲烷化”从而变废为宝,其反应机理如图乙所示,该反应的化学方程式为 。
(4)CO常用于工业冶炼金属,右图是在不同温度下CO还原四种金属氧化物达平衡后气体中lg[c(CO)/c(CO2)]与温度(t)的关系曲线图。下列说法正确的是 。
A.工业上可以通过增高反应装置来延长矿石和CO接触的时间,减少尾气中CO的含量
B.CO不适宜用于工业冶炼金属铬(Cr)
C.工业冶炼金属铜(Cu)时较低的温度有利于提高CO的利用率
D.CO还原PbO2的反应ΔH>0
(5)在载人航天器中应用电化学原理,以Pt为阳极,Pb(CO2的载体)为阴极,KHCO3溶液为电解质溶液,还原消除航天器内CO2同时产生O2和新的能源CO,总反应的化学方程式为:2CO2![]() 2CO+O2,则其阳极的电极反应式为 。
2CO+O2,则其阳极的电极反应式为 。
【答案】
(1)247
(2)①大于;CO2发生了其他副反应;②△S>0
(3)CO2+4H2![]() CH4+2H2O
CH4+2H2O
(4)BC(5)4OH--4e-=O2↑+2H2O
【解析】
试题分析:(1)已知:①CH4(g)═C(s)+2H2(g)△H=+75.0kJ/mol,②CO2(g)+H2(g)═CO(g)+H2O(g) △H=+41.0kJ/mol,③CO(g)+H2(g)═C(s)+H2O(g)△H=-131.0kJ/mol,反应CO2(g)+CH4(g)═2CO(g)+2H2(g)可以是①+②-③得到,根据盖斯定律计算反应的焓变△H=+247kJ/mol,故答案为:+247;
(2)①根据图示可以看出,CO2发生了其他副反应,同温度下CO2的平衡转化率大于CH4的平衡转化率大于;故答案为:大于;CO2发生了其他副反应;
②反应自发进行的判据:△H-T△S<0,反应①△S>0,△H>0,代入判据,得到反应在高温下能自发进行,故答案为:△S>0;
(3)据信息:一定条件下Pd-Mg/SiO2催化剂可使CO2“甲烷化”,可以写出方程式为:CO2+4H2![]() CH4+2H2O,故答案为:CO2+4H2
CH4+2H2O,故答案为:CO2+4H2![]() CH4+2H2O;
CH4+2H2O;
(4)A、增高炉的高度,增大CO与铁矿石的接触,不能影响平衡移动,CO的利用率不变,故A错误;B、由图象可知用CO工业冶炼金属铬时,lg[c(CO)/c(CO2)]一直很高,说明CO转化率很低,故不适合B正确;C、由图象可知温度越低lg[c(CO)/c(CO2)]越小,故CO转化率越高,故C正确;D、由图象可知CO还原PbO2的温度越高lg[c(CO)/c(CO2)]越高,说明CO转化率越低,平衡逆向移动,故△H<0,故D错误;故选:BC;
(5)以Pt为阳极,Pb(CO2的载体)为阴极,KHCO3溶液为电解质溶液,还原消除航天器内CO2同时产生O2和新的能源CO,总反应的化学方程式为:2CO2![]() 2CO+O2,则溶液中的氢氧根在阳极上失去电子发生氧化反应生成氧气,的电极反应式为:4OH--4e-=O2↑+2H2O;故答案为:4OH--4e-=O2↑+2H2O。
2CO+O2,则溶液中的氢氧根在阳极上失去电子发生氧化反应生成氧气,的电极反应式为:4OH--4e-=O2↑+2H2O;故答案为:4OH--4e-=O2↑+2H2O。


科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 铁与稀H2SO4反应时,加入少量CuSO4溶液,可使反应速率加快
B. 构成原电池的正极和负极必须是两种不同的金属
C. 在铁上镀铜时,金属铜作阴极
D. 用惰性电极电解CuSO4溶液,溶液的pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾是一种大气污染现象,不属于雾霾治理措施的是( )
A.植树绿化,美化环境 B.提倡绿色出行,发展公共交通
C.外出时佩戴防雾霾口罩 D.减少燃煤发电,增加太阳能发电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由徐光宪院士发起、院士学子同创的《分子共和国》科普读物最近出版了,全书形象生动地戏说了BF3、TiO2、HCHO、N2O、二茂铁、NH3、HCN、H2S、O3、异戊二烯和萜等众多“分子共和国”中的明星。
(1)写出Fe3+的基态核外电子排布式 。
(2)HCHO分子中碳原子轨道的杂化轨道类型为 ;1mol HCN分子中含有σ键的数目为__________mol。
(3)N2O的空间构型为 ,与N2O互分等电子体的一种离子为 。
(4)TiO2的天然晶体中,最稳定的一种晶体结构如下图,则黑球表示 原子。
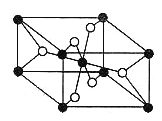
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某些资料认为:NO、NO2不能与Na2O2反应。某小组学生提出质疑,他们从理论上分析过氧化钠和二氧化氮都有氧化性,根据化合价升降原则提出假设:
假设Ⅰ.过氧化钠氧化二氧化氮
假设Ⅱ.二氧化氮氧化过氧化钠
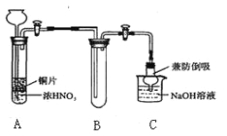
(1)小组甲同学设计实验如下:
①试管A中反应的化学方程式是 。
②待试管B中收集满气体,向试管B中加入适量 Na2O2粉末,塞紧塞子,轻轻振荡试管内粉末,观察到红棕色气体迅速消失;再将带火星的小木条迅速伸进试管内,发现木条复燃。甲同学认为假设Ⅱ正确;乙同学认为该装置不能达到实验目的。为准确达到实验目的,需在A、B之间增加一个装置,该装置的作用是 。
③乙同学用改进后装置,重复了甲同学的实验操作,观察到红棕色气体迅速消失;余烬木条未复燃。得出结论:假设Ⅰ正确。NO2和Na2O2反应的方程式是 。
(2)丙同学认为NO易与O2发生反应,应更易被Na2O2氧化。
查阅资料:①2NO+Na2O2=2NaNO2
②6NaNO2+3H2SO4=3Na2SO4+2HNO3+4NO↑+2H2O;
③酸性条件下,NO或NO2–都能与MnO4–反应生成NO3–和Mn2+
丙同学用下图所示装置(部分夹持装置略)探究NO与Na2O2的反应。

①B中观察到的主要现象是 ,F装置的作用是 。
②在反应前,打开弹簧夹,通入一段时间N2,目的是 。
③充分反应后,检验D装置中反应产物的实验方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 乙烯和乙醇均能被酸性高锰酸钾溶液氧化
B. 甲烷和苯均可在光照的条件下与氯气发生取代反应
C. 分子式为C2H6O的有机物均可在一定条件下与乙酸发生酯化反应
D. 蛋白质、油脂、葡萄糖均可在一定条件下发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的数值,下列叙述正确的是( )
A. 物质的量浓度为0.5 mol·L-1(NH4)2SO4溶液中,含有NH4+个数小于NA
B. 1mol羟基中电子数为10NA
C. 3.9gNa2O2晶体中阴阳离子总数为0.2NA
D. 含4molHCl的浓盐酸和足量MnO2加热反应可生成Cl2分子少于NA个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铜是人们最早使用的金属之一,下列关于铜电极的叙述不正确的是
A.铜锌原电池中铜是正极 B.用电解法精炼粗铜时粗铜做阳极
C.在镀件上镀铜时可用金属铜做阳极 D.电解水制H2、O2时铜做阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅酸钠被国家列为“我国优先发展的精细化学品”和“今后我国无机化工产品发展重点”之一。下图是用海边的石英砂(含氯化钠、氧化铁等杂质)制备硅酸钠的工艺流程示意简图:

(1)要将洗出液中的溶质析出,采用的方法是________(填“蒸发”、“降温”)结晶;操作时用到的硅酸盐仪器有(填3个仪器)____________________________。
(2)上述流程中加入NaOH溶液,反应的离子方程式为________________________。
(3)用上述残渣中的氧化铁焊接铁轨,其铝热反应的化学方程式为(并在方程式中用“单线桥”标出电子转移方向和数目)_____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com