
【题目】某溶液中只可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的若干种离子,且所含有的离子浓度均为
中的若干种离子,且所含有的离子浓度均为![]() 。某同学为确定其成分,进行如图所示实验:
。某同学为确定其成分,进行如图所示实验:
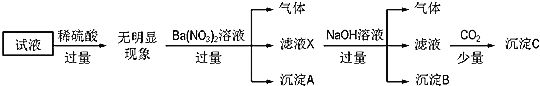
下列说法正确的是( )
A.无法确定原试液中是否含有![]() 、
、![]()
B.滤液X中大量存在的阳离子有![]() 、
、![]() 和
和![]()
C.无法确定沉淀C的成分
D.原溶液中存在的离子为![]() 、
、![]() 、
、![]() 、
、![]()
科目:高中化学 来源: 题型:
【题目】某溶液中加入金属铝有氢气放出,则在此溶液中可能大量共存的离子是( )
A.K+、Mg2+、NO3-、SO42-B.K+、Na+、Cl-、HCO3-
C.K+、Na+、AlO2-、SO42-D.K+、NH4+、Cl-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在工农业生产、生活中有着重要应用。
(1)烟气中的氮氧化物(NOx)可与甲烷在一定条件下反应转化为无害成分,从而消除污染。已知
反应 | 反应热(△H/kJ·mol-1) | 平衡常数(K) |
CH4(g)+2O2(g)═CO2(g)+2H2O(l) | a | K1 |
N2(g)+O2(g)═2NO(g) | b | K2 |
则CH4脱硝的热化学方程式为CH4(g) + 4NO (g)CO2(g) + 2N2(g) + 2H2O ΔH=_________kJ/mol(用a、b表示);平衡常数K3=_________(用K1、K2表示)。
(2)用活性炭还原法可以消除NO 的污染,发生的反应为C(s)+2NO(g)N2(g)+CO2(g)。1molNO 和足量的活性炭在T℃、容积恒定为2L的密闭容器中反应,经过5min反应达到平衡,测得NO的物质的量为0.4mol。
①从反应开始到5min,用氮气表示的平均反应速率为_________。达到平衡后,向容器中再通入0.1molNO气体和0.3molCO2气体,则此平衡将_________(填“正向移动”“不移动”或“逆向移动”)。
②能判断该反应一定达到化学平衡状态的依据是_________(填标号)。
a.NO和N2的体积比保持不变
b.单位时间内生成2nmolNO的同时消耗nmolCO2
c.恒温恒容条件下,反应体系的压强不再发生改变
d.恒容条件下,混合气体的平均相对分子质量不变
(3)某实验小组模拟4CO(g)+2NO2(g) 4CO2(g)+N2(g) ΔH=-1200kJ·mol-1净化过程,一定温度下,在2L的恒容密闭容器中,起始时按照甲、乙两种方式进行投料,经过一段时间后达到平衡状态,测得甲中CO的转化率为50%,则该反应的平衡常数为__________;两种方式达平衡时,N2的体积分数:甲______乙(填“>、=、<或不确定”)
甲 | 乙 |
0.2molNO2 | 0.1molNO2 |
0.4molCO | 0.2molCO |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是用途最广的金属材料之一,但生铁易生锈。请讨论电化学实验中有关铁的性质。
(1)①某原电池装置如图所示,右侧烧杯中的电极反应式为__,左侧烧杯中的c(Cl-)__(填“增大”、“减小”或“不变”)。
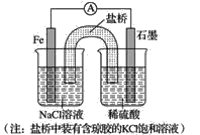
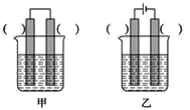
②已知如图甲、乙两池的总反应式均为Fe+H2SO4=FeSO4+H2↑,且在同侧电极(指均在“左电极”或“右电极”)产生H2。请在两池上标出电极材料_____(填“Fe”或“C”)。
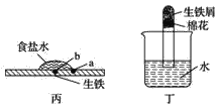
(2)装置丙中,易生锈的是__(填“a”或“b”)点。装置丁中可观察到的实验现象是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为防治碘缺乏病,通常在食盐中添加少量的碘酸钾(![]() )。碘酸钾和碘化钾在溶液中能发生如下反应:
)。碘酸钾和碘化钾在溶液中能发生如下反应:![]() 。下列有关叙述正确的是( )
。下列有关叙述正确的是( )
A.该反应中氧化剂为![]() ,还原剂为
,还原剂为![]()
B.该反应中,每生成3mol![]() 时转移的电子数目为5NA
时转移的电子数目为5NA
C.上述反应中,氧化产物与还原产物的质量之比为1:5
D.直接向食盐中加入淀粉溶液,可以判断该食盐是否为加碘食盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期。已知B元素L层电子数为K层上的2倍,D的原子核外存8种运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子。请回答下列问题:
(1)写出D原子基态的价层电子排布图:________。
(2)下列说法错误的是____________(填序号)。
A.二氧化硅的相对分子质量比二氧化碳大,所以沸点:![]()
B.电负性:![]()
C.![]() 与
与![]() 互为等电子体,结构相似,化学性质相似
互为等电子体,结构相似,化学性质相似
D.稳定性:![]() ,是因为水分子间存在氢键的缘故
,是因为水分子间存在氢键的缘故
(3)F离子是人体内多种酶的辅因子,人工模拟酶是当前研究的热点。向元素F的硫酸盐溶液中通入过量的气体X(X由C、A两种元素形成的含有10个电子的微粒)可生成![]() ,该离子的结构式为____________(用相关元素符号表示)。
,该离子的结构式为____________(用相关元素符号表示)。
(4)某化合物与F(Ⅰ)(Ⅰ表示元素F的化合价为+1价)结合形成如图所示的离子,该离子中碳原子的杂化方式是_______。
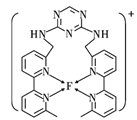
(5)已知![]() 是直线型分子,并有对称性,且分子中每个原子最外层都达到8电子稳定结构,则
是直线型分子,并有对称性,且分子中每个原子最外层都达到8电子稳定结构,则![]() 中σ键和π键的个数比为____。
中σ键和π键的个数比为____。
(6)C元素最高价含氧酸与硫酸酸性强度相近,原因是_______。
(7)B单质的一种同素异形体的晶胞如图所示:
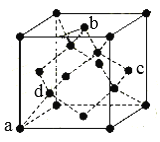
则一个晶胞中所含B原子个数为_____;其中原子坐标参数为:![]() ,
,![]() ,
,![]() ,则c点原子的坐标参数为______。(坐标系如图)
,则c点原子的坐标参数为______。(坐标系如图)
(8)D与F形成离子个数比为1:1的化合物晶胞与![]() 类似,D离子的配位数是________;设该晶胞的棱长为a pm,则该晶体的密度为________
类似,D离子的配位数是________;设该晶胞的棱长为a pm,则该晶体的密度为________![]() (用相关字母表示,已知阿伏加德罗常数为NA)
(用相关字母表示,已知阿伏加德罗常数为NA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将磁性氧化铁放入稀HNO3中可发生如下反应:3Fe3O4+28HNO3=9Fe(NO3)x+NO↑+14H2O。下列判断正确的是( )
A. Fe(NO3)x,中的x为![]()
B.反应中每生成0.2 mol还原产物,就有0.6 mol电子转移
C. HNO3在反应中只体现氧化剂
D.磁性氧化铁中的铁元素全部被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,将![]() 的氨水滴加到
的氨水滴加到![]() 的盐酸中,下列说法正确的是 ( )
的盐酸中,下列说法正确的是 ( )
A.若混合溶液中![]() ,则
,则![]()
B.若混合液中![]() ,则
,则![]()
C.若混合液中![]() ,则混合液的pH<7
,则混合液的pH<7
D.若![]() ,且混合液的pH<7,则一定
,且混合液的pH<7,则一定![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备叔丁基苯(![]() )的反应和有关数据如下:
)的反应和有关数据如下:
![]() +ClC(CH3)3
+ClC(CH3)3![]()
![]() +HCl
+HCl
物质 | 相对分子质量 | 密度/gcm-3 | 熔点/℃ | 沸点/℃ | 溶解性 |
AlCl3 | —— | —— | 190 | 易升华 | 遇水极易潮解并产生白色烟雾,微溶于苯 |
苯 | 78 | 0.88 | —— | 80.1 | 难溶于水,易溶于乙醇 |
氯代叔丁烷 | 92.5 | 1.85 | —— | 51.6 | 难溶于水,可溶于苯 |
叔丁基苯 | 134 | 0.87 | —— | 169 | 难溶于水,易溶于苯 |
I.如图是实验室制备无水AlCl3可能需要的装置:
A.  B.
B.  C.
C. 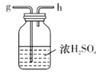 D.
D.  E.
E.  F.
F. 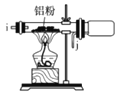
(1)检查B装置气密性的方法是__________。
(2)制备无水AlCl3的装置的合理的连接顺序为________(填小写字母),其中E装置的作用是___________。
(3)实验时应先加热圆底烧瓶再加热硬质玻璃管,其原因是________。
II.如图是实验室制备叔丁基苯的装置(夹持装置略):

在三颈烧瓶中加入50mL的苯和适量的无水AlCl,由恒压漏斗滴加氯代叔丁烷10 mL,一定温度下反应一段时间后,将反应后的混合物洗涤分离,在所得产物中加入少量无水MgSO4固体,静置,过滤,蒸馏得叔丁基苯20 g。
使用恒压漏斗的优点是_________;加入无水MgSO4固体的作用是____________________________________。
(5)洗涤混合物时所用的试剂有如下三种,正确的使用顺序是__________(填序号)
①5%的Na2CO3溶液 ②稀盐酸 ③H2O
(6)本实验中叔丁基苯的产率为______________(保留3位有效数字)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com