
【题目】某溶液 只含Cl-、![]() 、SO4 2-、Na+、K+、Mg2+六种离子中的某几种。经实验:
、SO4 2-、Na+、K+、Mg2+六种离子中的某几种。经实验:
①原溶液加过量的 NaOH 溶液,产生白色沉淀;
②过滤,取实验①滤液加 BaCl2 溶液不产生沉淀;
③取实验①滤液加稀硝酸酸化,再加 AgNO3 溶液产生白色沉淀, 下列说法不正确的是
A.实验 ① 中的白色沉淀为 Mg(OH)2
B.实验②证明原溶液中一定没有 CO3 2-、SO4 2-
C.原溶液中一定含有的离子是 Cl-、Na+、K+、Mg2+
D.有同学认为原溶液一定有 Cl-,实验③可以省略
【答案】C
【解析】
①溶液中加入过量NaOH生成白色沉淀,该沉淀应为Mg(OH)2,说明溶液中含有Mg2+,则不含有CO32-;②过滤,取实验①滤液加 BaCl2 溶液不产生沉淀,说明溶液中不含SO42-;③取实验①滤液加稀硝酸酸化,再加 AgNO3 溶液产生白色沉淀, 说明含有Cl-,据此分析解题。
①溶液中加入过量NaOH生成白色沉淀,该沉淀应为Mg(OH)2,说明溶液中含有Mg2+,则不含有CO32-;②过滤,取实验①滤液加 BaCl2 溶液不产生沉淀,说明溶液中不含SO42-;③取实验①滤液加稀硝酸酸化,再加 AgNO3 溶液产生白色沉淀, 说明含有Cl-;
A.由分析知:实验① 中的白色沉淀为 Mg(OH)2,故A正确;
B.由分析知:实验②证明原溶液中一定没有 CO3 2-、SO4 2-,故B正确;
C.由分析知:原溶液中一定含有的离子是Cl-和Mg2+,可能含有的离子是Na+、K+,故C错误;
D.由实验①溶液中一定含有Mg2+,实验②溶液中一定没有 CO3 2-、SO4 2-,结合溶液是电中性的,则溶液中一定含有Cl-,实验③可以省略,故D正确;
故答案为C。


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】据研究报道,药物瑞德西韦(Remdesivir)对2019年新型冠状病毒(COVID-19)有明显抑制作用。F为药物合成的中间体,其合成路线如下:
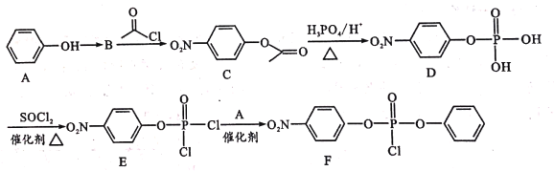
已知:R-OH![]() R-Cl
R-Cl
(1)A中官能团名称是________;C的分子式为_____
(2)A到B为硝化反应,则B的结构简式为___,A到B的反应条件是_____。
(3)B到C、D到E的反应类型 ________(填“相同”或“不相同”);E→F的化学方程式为________ 。
(4)H是C的同分异构体,满足下列条件的同分异构体有_____种。
①硝基直接连在苯环上
②核磁共振氢谱峰面积之比为2:2:2:1
③遇FeCl3溶液显紫色
(5)参照F的合成路线图,设计由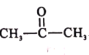 、SOCl2为原料制备
、SOCl2为原料制备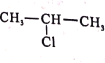 的合成路线_______(无机试剂任选)。
的合成路线_______(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是工业电解饱和食盐水的装置示意图,下列说法中不正确的是
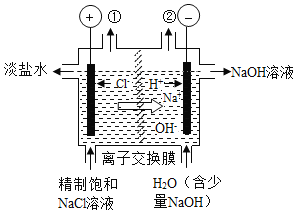
A. 装置出口①处的物质是氯气
B. 出口②处的物质是氢气,该离子交换膜只能让阳离子通过
C. 装置中发生的反应的离子方程式2Cl﹣+2H+![]() Cl2↑+H2↑
Cl2↑+H2↑
D. 该装置是将电能转化为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国在CO2催化加氢工艺方面取得突破性进展,CO2转化过程示意图如图,下列说法不正确的是( )
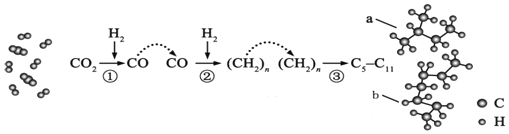
A. 过程![]() 中的产物中含有
中的产物中含有![]()
B. 该工艺在一定程度上能够拓宽获取汽油的途径
C. 产物中a和b互为同系物
D. 图中a的比例模型名称是![]() 甲基丁烷
甲基丁烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得,下列有关叙述正确的是( )
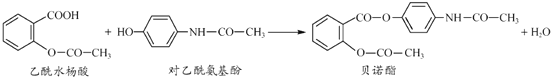
A. 根据有机物的分类,贝诺酯属于芳香烃,分子式为![]()
B. 乙酰水杨酸和对乙酰氨基酚均能与![]() 溶液反应放出
溶液反应放出![]()
C. 乙酰水杨酸和对乙酰氨基酚可用![]() 溶液区别
溶液区别
D. 1mol乙酰水杨酸最多能与2molNaOH发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应mA(s) + nB(g) ![]() eC(g) + f D(g),当其它条件不变时,C的百分含量(C%)和压强(P)的关系如图,下列叙述正确的是
eC(g) + f D(g),当其它条件不变时,C的百分含量(C%)和压强(P)的关系如图,下列叙述正确的是
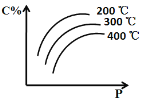
A. 化学方程式中n<e +f
B. 达到平衡后,若升温,v正减小,v逆增大
C. 达到平衡后,增加B的量,B的转化率增大
D. 若B为有色物质,达到平衡后缩小容器体积,重新达平衡后与原平衡比较气体颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应CO2+2NH3![]() CO(NH2)2+H2O可应用于工业合成尿素。下列表示反应中相关微粒的化学用语正确的是
CO(NH2)2+H2O可应用于工业合成尿素。下列表示反应中相关微粒的化学用语正确的是
A.中子数为8的碳原子:![]() CB.NH3的电子式:
CB.NH3的电子式:![]()
C.氧原子的结构示意图:![]() D.CO(NH2)2的结构简式:
D.CO(NH2)2的结构简式:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烟气中通常含有高浓度SO2、氮氧化物及粉尘颗粒等有害物质,在排放前必须进行脱硫脱硝处理。
(1) 利用甲烷可将氮氧化物还原为氮气除去。已知:
2NO(g)+O2(g)=2NO2(g);ΔH=a kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(g);ΔH=b kJ·mol-1
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g);ΔH=c kJ·mol-1
反应CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);ΔH=________ kJ·mol-1。
(2) H2O2在催化剂αFeOOH的表面上,分解产生·OH。·OH较H2O2和O2更易与烟气中的NO、SO2发生反应。反应后所得产物的离子色谱如图1所示。
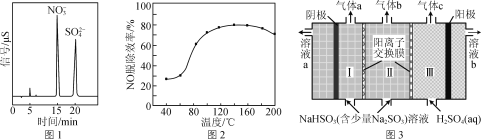
①写出·OH氧化NO的化学反应方程式:________。
②当H2O2浓度一定时,NO的脱除效率与温度的关系如图2所示。升温至80 ℃以上,大量汽化的H2O2能使NO的脱除效率显著提高的原因是______________________________,温度高于180 ℃,NO的脱除效率降低的原因是________。
(3) 工业可采用亚硫酸钠作吸收液脱除烟气中的二氧化硫。应用双阳离子交换膜电解技术可使该吸收液再生,同时得到高浓度SO2,其工作原理如图3所示。
① SO2气体在________(填“Ⅰ”“Ⅱ”或“Ⅲ”)室生成。
②用离子方程式表示吸收液再生的原理:________。
(4) 新型纳米材料氧缺位铁酸盐(ZnFe2Ox)能将烟气中SO2分解除去,若1 mol ZnFe2Ox与足量SO2生成1 mol ZnFe2O4和0.5 mol S,则x=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,水既不做氧化剂又不做还原剂的是
A. 2Na+2H2O=2NaOH+ H2↑B. 2H2O![]() 2H2↑ + O2↑
2H2↑ + O2↑
C. 2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑D. 2Na2O2+2H2O=4NaOH+ O2↑
2NaOH+H2↑+Cl2↑D. 2Na2O2+2H2O=4NaOH+ O2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com