
【题目】某化学反应2 A![]() B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(molL-1)随反应时间(min)的变化情况如下表所示。
B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(molL-1)随反应时间(min)的变化情况如下表所示。
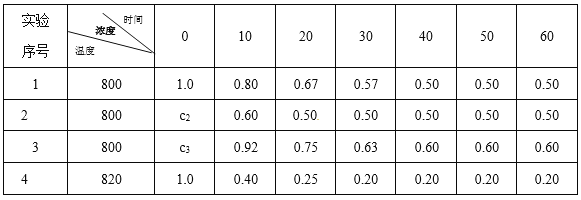
根据上述数据,完成下列填空:
(1)在实验1中,反应在10~20 min时间内A的平均反应速率为___________mol·L-1·min-1。
(2)在实验2中,A的初始浓度c2=________mol·L-1。
(3)设实验3的反应速率为v3。,实验1的反应速率为v1,则v3_____vl(填“>”、“="或“<”)。
(4)比较实验4和实验1,可推测该反应是_______(填“吸热”或“放热”)反应。
理由是_____________________________________________________________。
【答案】 0.013 1.0 > 吸热 温度升高时,平衡向右移动
【解析】(1)在实验1中,反应在10至20min时间内A的平均速率为v=![]() =
=![]() =0.013mol(Lmin)-1,故答案为:0.013;
=0.013mol(Lmin)-1,故答案为:0.013;
(2)反应经20minA的浓度不再改变,说明达到平衡,较其他实验达到平衡时间最短,故使用了合适的催化剂,起始浓度c2=1.0mol/L,故答案为:1.0;
(3)在实验1中,反应在10至20min时间内A的平均速率为v=![]() =
=![]() =0.013mol(Lmin)-1,在实验3中,反应在10至20min时间内A的平均速率为v=
=0.013mol(Lmin)-1,在实验3中,反应在10至20min时间内A的平均速率为v=![]() =
=![]() =0.015mol(Lmin)-1,故v3>v1,故答案为:>;
=0.015mol(Lmin)-1,故v3>v1,故答案为:>;
(4)比较实验4和实验1可知平衡时实验4反应物A的浓度小,由实验1到实验4升高温度,平衡右移,加热平衡向吸热反应方向移动,故答案为:吸热;由实验1到实验4升高温度,平衡右移,加热平衡向吸热反应方向移动。


科目:高中化学 来源: 题型:
【题目】已知水和苯不互相溶,苯不与钠反应,在烧杯中加水和苯(密度:0.88 g/mL)各50 mL。将一小粒金属钠(密度:0.97 g/mL)投入烧杯中,观察到的现象可能是
A. 钠在水层中反应并四处游动
B. 钠停留在苯层中不发生反应
C. 钠在苯的液面上反应并四处游动
D. 钠在苯与水的界面处反应,可能做上下跳动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列现象或事实不能用同一原理解释的是( )
A.浓硝酸和氯水用棕色试剂瓶保存
B.硫化钠和亚硫酸钠固体长期暴露在空气中变质
C.常温下铁和铂都不溶于浓硝酸
D.SO2和Na2SO3溶液都能使氯水褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是( S-32 O-16 )
A.标准状况下,22.4L氦气含有2NA个氦原子
B.在常温常压下,11.2L Cl2含有的分子数为0.5NA
C.常温常压下,64g SO2中含有的氧原子数为2NA
D.标准状况下,11.2LH2O含有的分子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于铅蓄电池的说法正确的是
A. 在放电时,正极发生的反应是Pb+SO42-=PbSO4+2e-
B. 在放电时,该电池的负极材料是铅板
C. 在充电时,电池中硫酸的浓度不断变小
D. 在充电时,阳极发生的反应是PbSO4+2e-=Pb+SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用钠熔法可定性确定有机物中是否存在氯、溴、硫、氮等元素。下列有关有机物与足量钠反应,各元素的转化结果正确的是
A. 碳元素转化为NaCN B. 氯元素转化为高氯酸钠
C. 溴元素转化为溴化钠 D. 硫元素转化为硫酸钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化学发展史的说法错误的是网]
A. 中国科学家成功合成了结晶牛胰岛素,标志着人类合成蛋白质时代的开始
B. 德国化学家李比希提出运用同位素示踪法研究化学反应历程
C. 瑞典科学家贝采利乌斯提出有机化学的概念,使之成为化学的一个重要分支
D. 德国化学家维勒用氰酸铵合成尿素,从而打破了无机物和有机物的界限
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】谢弗勒尔盐(Cu2SO3·CuSO3·2H2O)是一种深红色固体,不溶于水和乙醇,100℃时发生分解。可由CuSO4·5H2O和SO2等为原料制备,实验装置如下图所示:

(1)装置A在常温下制取SO2时,用较浓的硫酸而不用稀硫酸,其原因是_______________。
(2)装置B中发生反应的离子方程式为_______________。
(3)装置C的作用是____________________。
(4)从B中获得的固体需先用蒸馏水充分洗涤,再真空干燥。
①检验洗涤已完全的方法是__________________。
②不用烘干的方式得到产品,其原因是________________。
(5)请补充完整由工业级氧化铜(含少量FeO)制备实验原料(纯净CuSO4·5H2O)的实验方案:向工业级氧化铜中边搅拌边加入稍过量的硫酸溶液,微热使其完全溶解,_______________,过滤,用95%酒精洗涤晶体2~3次,晾干,得到CuSO4·5H2O。
[已知:①该溶液中氢氧化物开始沉淀与沉淀完全时的pH范围分别为:Fe(OH)2(5.8,8.8);Cu(OH)2(4.2,6.7);Fe(OH)3(1.1,3.2)。②在水溶液中超过100℃,硫酸铜晶体易失去结晶水。③硫酸铜晶体溶解度曲线如右图所示]

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com