
加碘食盐中含有的碘酸钾是一种白色结晶粉末,常温下很稳定,加热至560℃开始分解。在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应。工业生产碘酸钾的流程如下:
(1)步骤②中氢氧化钾的主要作用是 。
(2)参照下表碘酸钾的溶解度,操作③得到碘酸钾晶体,可经过 、过滤、洗涤、干燥等步骤。
| 温度/℃ | 20 | 40 | 60 | 80 |
| KIO3/100g水 | 8.08 | 12.6 | 18.3 | 24.8 |
(1)与KH(IO3)2反应使其转化为KIO3 (2)蒸发结晶
(3)① 碱式滴定管 锥形瓶 。② 淀粉溶液 溶液的蓝色消失且半分钟内不再变化 ③B ④1.27/3w
解析试题分析:(1)碘单质与氯酸钾在水中发生反应产生KH(IO3)2,加入KOH时可以使之转化为KIO3。(2)由于碘酸钾的溶解度受温度的影响变化不大,所以从KIO3溶液中得到晶体的操作方法是采用蒸发溶剂结晶、过滤、洗涤、干燥等步骤。(3)①由题意可知是用Na2S2O3溶液滴定I2的水溶液。Na2S2O3溶液显碱性所以在滴定过程中,所用的玻璃仪器为碱式滴定管和锥形瓶。②由于单质I2遇淀粉溶液显蓝色。所以可以利用淀粉溶液作指示剂。当达到滴定终点时现象是溶液的蓝色消失且半分钟内不再变化。③A滴定管在使用前必须检查是否漏水并润洗。正确。B滴定时眼睛要注视锥形瓶中溶液颜色的变化。错误。C.可用少量的蒸馏水冲洗锥形瓶内壁,扩大溶液的体积,可以使滴定过程中锥形瓶中物质的浓度减小,这样可以减小实验误差,提高实验的准确度。正确。D.终点读数时若俯视会导致滴定所用Na2S2O3溶液的体积偏小,以此为标准计算的碘的含量就偏低。正确。故有关该滴定实验的说法不正确的是B。④由方程式KIO3+5KI+3H2SO4= 3K2SO4+3I2+3H2O;I2+2S2O32-=2I-+S4O62-可得关系式KIO3—— 3I2 —— 6S2O32-.n(Na2S2O3)=2.00×10-5mol.所以n(KIO3)=1/3×10-5mol.所以碘元素的质量为1/3×10-5mol ×127g/mol =1.27/3×10-3g.所以该加碘食盐样品中的碘元素含量是1.27/3×10-3g÷w×10-3Kg=1.27/3w.
考点:考查滴定法在测定物质组成的应用及滴定终点的判断、指示剂的选择、误差分析等知识。


科目:高中化学 来源: 题型:单选题
下列叙述错误的是
| A.易燃试剂应与强氧化性试剂分开放置并远离火源 |
| B.某溶液中加入盐酸,有白色沉淀生成,说明原溶液中一定存在Ag+ |
| C.用50 mL酸式滴定管可准确量取25.00 mL的KMnO4溶液 |
| D.氢氧化铁胶体加热蒸干、灼烧后有氧化铁生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列叙述正确的是( )
①装置甲可防止铁钉生锈
②装置乙可除去乙烯中混有的乙炔
③装置丙可验证HCl气体在水中的溶解性
④装置丁可用于实验室制取乙酸乙酯
⑤装置戊既可用于收集H2、CO2、Cl2和HCl气体,也可用于干燥H2、CO2、Cl2和HCl气体。
| A.①⑤ | B.④⑤ | C.①② | D.③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下面所列的是中学化学实验室中几种常见的玻璃仪器:
①温度计 ②容量瓶 ③滴定管 ④烧杯 ⑤圆底烧瓶 ⑥量筒 ⑦玻璃棒
(1)在仪器上标明具体使用温度的是(不考虑温度计)_______(填写编号);可作反应容器并可加热的是________(填写编号)。
(2)需要用温度计的实验是________(填写编号)。
①石油分馏 ②浓硫酸稀释 ③测定硝酸钾的溶解度
(3)玻璃棒的作用主要有以下三种。不同实验中其作用可能不完全相同,请回答下列问题:
①搅拌 ②引流 ③蘸取溶液
A.在“用无水碳酸钠配制100 mL 0.12 mol·L-1的碳酸钠溶液”的实验中,玻璃棒的作用是________(填写编号)。
B.在“用氢氧化钠溶液、碳酸钠溶液、氯化钡溶液、盐酸、水等试剂除去粗盐中的Mg2+、Ca2+、SO42-等杂质离子以获得纯净的食盐”的实验中玻璃棒的作用可能是________(填写编号)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上以锂辉石(Li2O·Al2O3·4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下:
已知:①Li2O·Al2O3·4SiO2 H2SO4(浓)
H2SO4(浓) Li2SO4
Li2SO4 Al2O3·4SiO2·H2O↓
Al2O3·4SiO2·H2O↓
②某些物质的溶解度(S)如下表所示:
| T/℃ | 20 | 40 | 60 | 80 |
 (Li2CO3)/g (Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
 (Li2SO4)/g (Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有关钴和铁化合物的性质见下表:
| 化学式 | 溶度积(室温时)Ksp | 沉淀完全时的pH | 氯化钴晶体的性质 |
| Co(OH) 2 | 5.9×10-15 | 9.4 | CoCl2·6H2O呈红色,常温下稳定。110ºC~120ºC时脱水变成蓝色无水氯化钴 |
| Fe(OH) 2 | 1.6×10-14 | 9.6 | |
| Fe(OH) 3 | 1.0×10-35 | x |
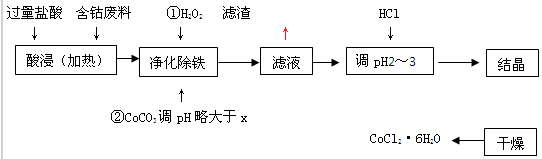
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
为了测定含有H2C2O4·2H2O、KHC2O4和K2SO4的试样中各物质的质量分数,进行如下实验:
①称取6.0 g试样,加水溶解,配成250 mL试样溶液。
②用酸式滴定管量取25.00 mL试样溶液放入锥形瓶中,并加入2~3滴酚酞试液,用0.2500 mol/L NaOH溶液滴定,消耗NaOH溶液20.00 mL。
③再取25.00 mL试样溶液放入另一锥形瓶中,用0.1000 mol/L的酸性高锰酸钾溶液滴定,消耗高锰酸钾溶液16.00 mL。
回答下列问题:
(1)已知:0.10 mol/L KHC2O4溶液pH约为3,其中含碳元素的粒子浓度由大到小的顺序为 。
(2)步骤①所需要的玻璃仪器有烧杯、玻璃棒、 。
(3)完成并配平下列离子方程式: C2O42-+ MnO4-+ H+= CO2+ Mn2++
(4)滴定时边滴边摇动锥形瓶,眼睛应观察 。
(5)步骤②中量取试样溶液时,酸式滴定管用蒸馏水洗过后没有润洗,则测得的H2C2O4·2H2O的质量分数 。(填“偏大”、“偏小”或“无影响”)
(6)步骤③中判断滴定终点的方法是 。
(7)试样中H2C2O4·2H2O的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
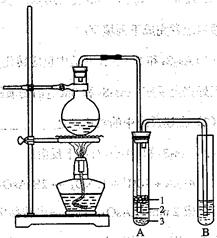
(15分)
某化学兴趣小组的同学为制取少量溴乙烷,查阅资料得知:
NaBr+H2SO4 HBr+NaHSO4
HBr+NaHSO4
CH3CH2OH+HBr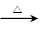 CH3CH2Br+H2O
CH3CH2Br+H2O
化学兴趣小组根据实验原理设计如右图的装置。
根据题意完成下列填空:有关数据列表如下:
| | 乙醇 | 溴乙烷 |
| 状态 | 无色液体 | 无色液体 |
| 密度/g · cm-3 | 0.8 | 1.4 |
| 沸点/℃ | 78.5 | 119.0 |
| 熔点/℃ | -l30 | 38.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
实验需要0.1 mol/L NaOH溶液450 mL,根据溶液配制中的情况回答下列问题:
(1)实验中除了托盘天平、烧杯、容量瓶外还需要的其他仪器有___ ___
_______________________________________________ __________。
(2)根据计算得知,所需NaOH的质量为________g。
(3)配制一定物质的量浓度溶液的实验中,如果出现以下操作
| A.称量时用了生锈的砝码 |
| B.将NaOH放在纸张上称量 |
| C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中 |
| D.往容量瓶转移时,有少量液体溅出 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com