
����Ŀ��������Ԫ��W��Y��Z��ԭ��������������W��Y����������֮��ΪX��������������2����Z�����������������ڲ��������X��Y��Z�ļ����ӵĵ��Ӳ�ṹ��ͬ��W�ĵ����ǿ�������������������壬����˵����ȷ����
A. ���Ӱ뾶�Ĵ�С˳��r(W)��r(X)��r(Y)��r(Z)
B. W����̬�⻯���X���ȶ�
C. XY2��ZY2�еĻ�ѧ��������ͬ
D. Y������������Ӧˮ��������Ա�W��ǿ
���𰸡�A
�����������������������Ԫ��W��X��Y��Z ��ԭ��������������W�ĵ����ǿ�������������������壬��WΪNԪ�أ�Z�����������������ڲ��������ԭ����������NԪ�أ�ֻ�ܴ��ڵ������ڣ���ZΪMgԪ�أ�X��Y��Z�ļ����ӵĵ��Ӳ�ṹ��ͬ���ṹԭ��������֪��Xֻ�ܴ��ڵڶ����ڣ�����������������5��W(��Ԫ��)��Y����������֮��ΪX��������������2������Yԭ������������ֻ��Ϊ���������ԭ��������֪��Y�����ܴ�����A�壬ֻ�ܴ�����A�壬��YΪFԪ�أ�X����������Ϊ![]() =6����XΪOԪ�أ�A��W��X��Y��Z �����Ӿ�����ͬ�Ľṹ���˵����Խ�����Ӱ뾶ԽС�������Ӱ뾶r(W)��r(X)��r(Y)��r(Z)����A��ȷ��B���ǽ�����O��N�����⻯���ȶ���H2O��NH3����B����C��OF2�к��й��ۼ���MgF2�к������Ӽ�������ѧ�����Ͳ�ͬ����C����D��YΪFԪ�أ������ۣ�����������������D���ʴ�ΪA��
=6����XΪOԪ�أ�A��W��X��Y��Z �����Ӿ�����ͬ�Ľṹ���˵����Խ�����Ӱ뾶ԽС�������Ӱ뾶r(W)��r(X)��r(Y)��r(Z)����A��ȷ��B���ǽ�����O��N�����⻯���ȶ���H2O��NH3����B����C��OF2�к��й��ۼ���MgF2�к������Ӽ�������ѧ�����Ͳ�ͬ����C����D��YΪFԪ�أ������ۣ�����������������D���ʴ�ΪA��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(2015���Ϻ����ֲ�����ҩ��³����E���ṹ��ʽΪ ���������ϳ�·������ͼ��ʾ�����ַ�Ӧ�Լ���������ʡ�ԣ���
���������ϳ�·������ͼ��ʾ�����ַ�Ӧ�Լ���������ʡ�ԣ���
��1����A��һ��̼ԭ�ӣ���һ�����ֻ��3�ֵ�A��ͬϵ��������� ��
��2��д����Ӧ�Լ��ͷ�Ӧ��������Ӧ�� ����
��3����Ʒ�Ӧ�ڵ�Ŀ���� ��
��4��B�Ľṹ��ʽΪ ��C�������� ��
��5��д��һ����������������D��ͬ���칹��Ľṹ��ʽ��
�ٷ����廯���� ���ܷ���ˮ�ⷴӦ ����3�ֲ�ͬ��ѧ��������ԭ��
1 mol��������NaOH��Һ����������� mol NaOH��
��6����³����������ϳ�·���У���һ���ϳ�·����ڶ�������������Ȳ�̫���룬������ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Xԭ�ӵĺ˵����Ϊa������������Xm����Yԭ�ӵ�������Yn���ĵ��Ӳ� �ṹ��ͬ����Yԭ�ӵĺ˵����Ϊ�� ��
A.a��m��nB.a��m��nC.m��n��aD.m��n��a
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���Ũ��Ϊ0.1mol/L�����ΪV L�İ�ˮ����μ���һ��Ũ�ȵ����ᣬ��pH�Ʋ���Һ��pH������ļ����������͵ĵζ����ߣ�d��������Һǡ����ȫ��Ӧ������ͼ�ش��������⣺
��1�����¶�ʱ��ˮ�ĵ���ƽ�ⳣ��K= ��
��2���Ƚ�b��c��d����ʱ����Һ�У�ˮ���� ��c��OH������С˳��Ϊ ��
��3���ζ�ʱ����b�㵽c��Ĺ����У����и�ѡ������ֵ���ֲ������ ��
A.c��H+��c��OH����
B.![]()
C.![]()
D.![]()
��4���������ϵζ������ж�����˵����ȷ���ǣ���Һ��NԪ��ֻ����NH4+�� NH3H2O������ʽ�� ��
A.��b��ʾ��Һ�У�c��NH4+��+c��H+��=c��NH3H2O��+c��OH����
B.�� c��ʾ��Һ�У�c��Cl����=c��NH3H2O��+c��NH4+��
C.�� d��ʾ��Һ�У�c��Cl������c��H+����c��NH4+����c��OH����
D.�ζ��п����У�c��NH3H2O����c��NH4+����c��OH������c��Cl������c��H+��
��5���ζ����������������pH= �� d��֮������������������ͼ���е�e�㣨��ʱ������NH4+ˮ���Ӱ�죩����e���Ӧ�ĺ�����Ϊ �� 
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������п����þƾ���ֱ�Ӽ��ȵ�һ���ǣ� ��
A.�Թܡ�������
B.�Թܡ��ձ�
C.�Թܡ�ƽ����ƿ
D.������Բ����ƿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Զ�������г���Ӧ��ԭ���ԭ���Ĵ���������ͼΪ��صĹ���ʾ��ͼ��������ɢ���봫�����������е缫�Ϸ�����Ӧ���������ͻ���յ����źţ��±��г��˴������弰���е缫�ϲ��ַ�Ӧ���
�������� | ���ֵ缫��Ӧ���� |
NO2 | NO |
Cl2 | HCl |
CO | CO2 |
H2S | H2SO4 |
������˵������ȷ���ǣ� ��
A.����������ʱ�����е缫�����������
B.���Cl2����ʱ�����е缫�ĵ缫��ӦΪ��Cl2+2e���T2Cl��
C.���H2S����ʱ���Ե缫����������Ե缫�ϵĵ缫��ӦʽΪO2+2H2O+4e���T4OH��
D.���H2S��CO���������ͬ�����ݿ�������ʱ���������ϲ����ĵ�����С��ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�ܱ������г�������ʵ���������A��B��һ���¶��·�����ӦA��g��+xB��g��2C��g�����ﵽƽ���ֻ�ı䷴Ӧ��һ��������������������ʵ�Ũ�ȡ���Ӧ������ʱ��仯��ͼ��ʾ������˵������ȷ���ǣ� �� 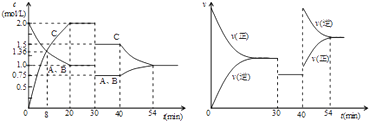
A.30minʱ�����¶ȣ�40minʱ����������C
B.0��8min��A��ƽ����Ӧ����Ϊ0.08mol/��Lmin��
C.��Ӧ����ʽ�е�x=1������ӦΪ���ȷ�Ӧ
D.20min��40min��÷�Ӧ��ƽ�ⳣ����Ϊ8
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ȿ��Լ����������ϩ���ֿ��Գ�ȥ�����л��е���ϩ���õ���������ķ�����
A. ������Cl2��Ӧ B. ͨ��������ˮ��
C. ��һ��������ͨ������ D. ͨ���������������Һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Դ�ǵ����о����ȵ����⣮�����ѣ�CH3OCH3����δ������������ͺ�Һ������Ϊ�ྻҺ��ȼ��ʹ�ã���ҵ����CO��H2Ϊԭ������CH3OCH3 �� ��ҵ�Ʊ��������ڴ���Ӧ���У�ѹ��2.0��10.0Mpa���¶�230��280�棩�������з�Ӧ��
��CO��g��+2H2��g��CH3OH��g����H1=��99kJmol��1
��2CH3OH��g��CH3OCH3��g��+H2O��g����H2=��23.5kJmol��1
��CO��g��+H2O��g��CO2��g��+H2��g����H3=��41.2kJmol��1
��1������Ӧ���е��ܷ�Ӧ3CO��g��+3H2��g��CH3OCH3��g��+CO2��g���������H= �� ��Ӧԭ������ú����������֪�÷�Ӧ��ƽ�ⳣ������ʽΪK= ![]() ��ÿ����1mol H2��Ҫ����131.3kJ��������д���÷�Ӧ���Ȼ�ѧ����ʽ ��
��ÿ����1mol H2��Ҫ����131.3kJ��������д���÷�Ӧ���Ȼ�ѧ����ʽ ��
��2���ڸ������£�����Ӧ�ٵ���ʼŨ�ȷֱ�Ϊ��c��CO��=0.6molL��1 �� c��H2��=1.4molL��1 �� 8min��ﵽƽ�⣬CO��ת����Ϊ50%����8min��H2��ƽ����Ӧ����Ϊ ��
��3����t��ʱ����Ӧ�ڵ�ƽ�ⳣ��Ϊ400�����¶��£���1L���ܱ������м���һ���ļ״�����Ӧ��ijʱ�̲�ø���ֵ����ʵ���Ũ�����£�
���� | CH3OH | CH3OCH3 | H2O |
c��molL��1�� | 0.46 | 1.0 | 1.0 |
��ʱ��v��v�����������������=������ƽ��ʱc��CH3OCH3�������ʵ���Ũ���� ��
��4���ڣ�1��С���д���Ӧ�ҵ��ܷ�Ӧ3CO��g��+3H2��g��CH3OCH3��g��+CO2��g����CO��ƽ��ת����a��CO�����¶ȡ�ѹǿ�Ĺ�ϵ��ͼ1��ʾ��ͼ��X��������¶ȡ���ѹǿ�����жϵ������� 
��5���ڴ�����������ͬʱ����������Ӧ������������ʼͶ�ϱ� ![]() �ĸı䣬�����Ѻͼ״��IJ��ʣ������е�̼ԭ��ռ��ʼCO��̼ԭ�ӵİٷ��ʣ�������ͼ2�ı仯���ƣ��Խ��Ͷ����Ѳ��ʺͼ״����ʱ仯��ԭ��
�ĸı䣬�����Ѻͼ״��IJ��ʣ������е�̼ԭ��ռ��ʼCO��̼ԭ�ӵİٷ��ʣ�������ͼ2�ı仯���ƣ��Խ��Ͷ����Ѳ��ʺͼ״����ʱ仯��ԭ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com