
A、B、C、X均为中学化学常见的物质,一定条件下,它们有如下转化关系(部分产物已略去),下列说法错误的是

A.若X为Cl2,则C可能为FeCl3
B.若X为KOH溶液,则A可能为AlCl3溶液
C.若X为O2,则A可能为H2S或NH3
D.若A、B、C均为焰色反应呈黄色的化合物,则X可能为CO2
科目:高中化学 来源:2014-2015学年福建省泉州五校高三上学期摸底联考化学试卷(解析版) 题型:选择题
氮化钠和氢化钠都是离子化合物,与水反应的化学方程式(未配平)如下:Na3N+H2O→NaOH+NH3,NaH+H2O→NaOH+H2。有关它们的叙述 ①与水反应都是氧化还原反应;②与水反应后的溶液都显碱性;③与盐酸反应都只生成一种盐;④两种化合物中的阴阳离子均具有相同的电子层结构。其中正确的是
A.①②③④ B.①②③ C.②③ D.②
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省商丘市高三第一次模拟考试化学试卷(解析版) 题型:推断题
(12分)已知A、B、D为中学常见的单质,甲、乙、丙、丁、戊为短周期元素组成的化合物。其中,丙是一种能使湿润的红色石蕊试纸变蓝的无色气体;丁是一种高能燃料,其组成元素与丙相同,1mol丁分子中不同原子的数目比为1 :2,且含有18 mol电子;戊是一种难溶于水的白色胶状物质,既能与强酸反应,也能与强碱反应,具有净水作用。各物质问的转化关系如图所示(某些条件已略去)。请回答:

(1)甲和水反应生成戊和丙的化学方程式为_______________________。
(2)乙与强碱反应的离子方程式:________________________。
(3)丁中所包含的化学键类型有___________________(填字母序号)。
a.离子键 b.极性共价键 c.非极性共价键
丙分子溶于水所得溶液中含有的氢键有____________种。
(4)利用单质B与D为原料、含H+的固体物质作电解质,以金属铂为电极材料组成原电池制备丙,则生成产物丙的电极反应式为______________。
(5)反应②中,0.5molNaClO参加反应时,转移1mol电子,其化学方程式为:______________。
(6)一定条件下,A与TiO2、C(石墨)反应只生成乙和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分。已知该反应生成l mol乙时放出536kJ热量,其热化学方程式为:___________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省商丘市高三第一次模拟考试化学试卷(解析版) 题型:选择题
Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O。当产物n(NO2) :n(NO)=1 :1时,下列说法不正确的是
A.反应中Cu2S是还原剂,Cu(NO3)2、CuSO4是氧化产物
B.参加反应的n(Cu2S) :n(HNO3)=1 :7
C.产物n[Cu(NO3)2] :n[CuSO4]=1 :2
D.1 molCu2S参加反应时有10 mol电子转移
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市海淀区高三年级3月适应性训练理综化学试卷(解析版) 题型:实验题
(15分)某NiO的废料中有FeO、CuO、Al2O3、MgO、SiO2等杂质,用此废料提取NiSO4和Ni的流程如下:

已知:有关金属离子生成氢氧化物沉淀所需的pH如下图:

(1)滤渣1的主要成分为 。
(2)电解脱铜:金属铜在 极析出。
(3)①用离子方程式解释加入H2O2的作用 。
②加Na2CO3调节溶液的pH至5,则滤渣2的主要成分为 。
(4)从滤液2中获得NiSO4.6H2O的实验操作是 、过滤、洗涤、干燥。
(5)电解浓缩后的滤液2可获得金属镍,其基本反应原理示意图如下:

①A极的电极反应式为 和2H++2e-=H2↑。
②B极附近pH会 (填“增大”、“减小”或“不变”);用平衡移动原理解释B极附近pH变化的原因: 。
③若一段时间后,在A、B两极均收集到11.2L气体(标准状况下),理论上能得到Ni g。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市海淀区高三年级3月适应性训练理综化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.银氨溶液可以用于区分麦芽糖和蔗糖
B.乙醇、乙二醇、丙三醇的沸点依次升高
C.1mol乙酰水杨酸( )最多可以和2mol NaOH反应
)最多可以和2mol NaOH反应
D.可用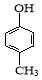 和HCHO 为原料合成
和HCHO 为原料合成
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省文登市高三第二次统考理科综合化学试卷(解析版) 题型:填空题
(20分)近年来大气问题受到人们越来越多的关注。按要求回答下列问题:
Ⅰ.实现反应CH4(g)+CO2(g) 2CO(g)+2H2(g),△H0,对减少温室气体排放和减缓燃料危机具有重要意义。在2L密闭容器中,通入5mol CH4与5mol CO2的混合气体,一定条件下发生上述反应,测得CH4的平衡转化率与温度、压强的关系如图。
2CO(g)+2H2(g),△H0,对减少温室气体排放和减缓燃料危机具有重要意义。在2L密闭容器中,通入5mol CH4与5mol CO2的混合气体,一定条件下发生上述反应,测得CH4的平衡转化率与温度、压强的关系如图。

则p1、p2、p3、p4由大到小的顺序 ,该反应的正反应是______(填“吸热”或“放热”)反应,当1000℃甲烷的转化率为80%时,该反应的平衡常数K=________。
Ⅱ.PM2.5污染与直接排放化石燃烧产生的烟气有关,化石燃料燃烧同时放出大量的SO2和NOx。
(1)处理NOx的一种方法是利用甲烷催化还原NOx。
CH4(g) + 4NO2(g) = 4NO(g) + CO2(g) + 2H2O(g) △H1=-574kJ·mol-1
CH4(g) + 4NO(g) = 2N2(g) + CO2(g) + 2H2O(g) △H2=-1160kJ·mol-1
CH4(g) + 2NO2 (g) = N2(g) + CO2(g) + 2H2O(g) △H3
则△H3= ,如果三个反应的平衡常数依次为K1、K2、K3,则K3=__________(用K1、K2表示)
(2)实验室可用NaOH溶液吸收SO2,某小组同学在室温下,用pH传感器测定向20mL0.1mol·L-1NaOH溶液通入SO2过程中的pH变化曲线如图所示。
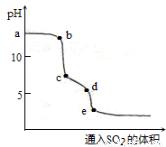
①ab段发生反应的离子方程式为________________。
②已知d点时溶液中溶质为NaHSO3,此时溶液中离子浓度由大到小的顺序为_______,如果NaHSO3的水解平衡常数Kh=1×10-12mol·L-1,则该温度下H2SO3的第一步电离平衡常数Ka=________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省宁波市高三上学期期末考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.高炉炼铁中焦炭直接还原化合态的铁
B.工业上常用液氨作制冷剂
C.元素分析仪是一种可用于确定化学反应速率的比色分析仪器
D.12C可用于考古断代
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com