
����Ŀ�����·�ZnS��BaSO4��Ҳ��п���ף�����һ�ֳ��ð�ɫ���ϡ��ش��������⣺
���ؾ�ʯ��BaSO4��Ϊԭ�ϣ��ɰ����¹����������·ۣ�

���ڻ�תҤ���ؾ�ʯ��������̿��ԭΪ�����������ù��̵Ļ�ѧ����ʽΪ____________________________����תҤβ���к����ж����壬�����Ͽ�ͨ��ˮ�����任��Ӧ����ת��ΪCO2��һ�������Դ���壬�÷�Ӧ�Ļ�ѧ����ʽΪ_______________________��
�ڳ������з�Ӧ�����ӷ���ʽΪ___________________________��
���𰸡�BaSO4+4C![]() BaS+4CO�� CO+H2O
BaS+4CO�� CO+H2O![]() CO2+H2 S2+Ba2++Zn2++
CO2+H2 S2+Ba2++Zn2++![]() =ZnS��BaSO4��
=ZnS��BaSO4��
��������
�ؾ�ʯ(BaSO4)�ͽ�̿�ۻ���ڻ�ת¯�з�Ӧ����ΪBaS��CO��������ԭ�ϡ������õ�������BaS��Һ���ټ�������п��Ӧ�õ�ԭ�����·�ZnSBaSO4���پ���������ϸ���յó�Ʒ��
���ڻ�תҤ���ؾ�ʯ��������̿��ԭΪ����������Һ��CO���䷴Ӧ�Ļ�ѧ����ʽΪBaSO4+4C![]() BaS+4CO������תҤβ���к����ж����壬�����Ͽ�ͨ��ˮ�����任��Ӧ����ת��ΪCO2��һ�������Դ���弴�������÷�Ӧ�Ļ�ѧ����ʽΪCO+H2O
BaS+4CO������תҤβ���к����ж����壬�����Ͽ�ͨ��ˮ�����任��Ӧ����ת��ΪCO2��һ�������Դ���弴�������÷�Ӧ�Ļ�ѧ����ʽΪCO+H2O![]() CO2+H2���ʴ�Ϊ��BaSO4+4C
CO2+H2���ʴ�Ϊ��BaSO4+4C![]() BaS+4CO����CO+H2O
BaS+4CO����CO+H2O![]() CO2+H2��
CO2+H2��
�ڳ���������BaS��Һ��ZnSO4��Һ��Ӧ����ZnS��BaSO4���䷴Ӧ�����ӷ���ʽΪS2+Ba2++Zn2++ SO42 = ZnS��BaSO4�����ʴ�Ϊ��S2+Ba2++ Zn2+ + SO42=ZnS��BaSO4����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��5������������������Ҫ���л��ϳ��м��壬��������Ȼ���ʰ������صĺϳɣ�һ���Լ䱽����Ϊԭ�ϵĺϳɷ�Ӧ���£�

�״������Ѻ�3��5�������������ӵIJ����������ʼ��±���

��1����Ӧ�������ȷ�����״����ټ������ѽ�����ȡ���ٷ�����״��IJ����ǵ�______������ȡ�õ��ķ�Һ©��ʹ��ǰ��__________________��ϴ������Һʱ�л����ڷ�Һ©����________����ϡ����¡����㣻
��2������õ����л��������ñ���NaHCO3��Һ������ʳ��ˮ����������ˮ����ϴ�ӣ��ñ���NaHCO3��Һϴ�ӵ�Ŀ����__���ñ���ʳ��ˮϴ�ӵ�Ŀ����______��
��3��ϴ����ɺ�ͨ�����²������롢�ᴿ�����ȷ�IJ���˳����__������ĸ����
a�������ȥ���� b���ؽᾧ c�����˳�ȥ����� d��������ˮCaCl2����
��4����Һ���볣���ü�ѹ���ˣ�Ϊ�˷�ֹ��������ѹ������ɺ�Ӧ��________________����______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�ֻ�����Ľṹ��ͼ��ʾ������X��Y��Z��Q��WΪԭ������������������ֶ�����Ԫ�أ�Q����������������Y�������������ͬ��X��ԭ�Ӱ뾶��Ԫ�����ڱ�����С�ġ�����������ȷ����
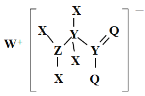
A.Z������������Ӧ��ˮ������һԪǿ��
B.WX��ˮ��Һ������
C.Ԫ�طǽ����Ե�˳��ΪY��Z��Q
D.�û���������Y����������Q������8�����ȶ��ṹ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������һ�����������Ƥ��Tϸ���ܰ�����ҩ���ṹ��ͼ��ʾ�������й�˵����ȷ����

A. ����������̼ԭ����ͬһƽ����
B. ���ܷ����ӳɷ�Ӧ�����ܷ�����ȥ��Ӧ
C. ��ʹ��ˮ�����Ը��������Һ��ɫ����ԭ����ͬ
D. 1mol�������ֱ���������Na�� NaHCO3��Ӧ��������������ʵ���֮��Ϊl�U2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.�ݱ������ҹ����Ϻ��������������еĿ�ȼ��(�����ˮ����)�Բɻ�óɹ���������һ����Ҫ�Ļ���ԭ�ϡ�
(1)��������������������ʵ���Ҫ��ʽ����������������������֣�
ˮ����������CH4(g)��H2O(g) ![]() CO(g)��3H2(g)����H1����205.9 kJ��mol��1�� ��
CO(g)��3H2(g)����H1����205.9 kJ��mol��1�� ��
CO(g)��H2O(g) ![]() CO2(g)��H2(g)����H2����41.2 kJ��mol��1����
CO2(g)��H2(g)����H2����41.2 kJ��mol��1����
������̼������CH4(g)��CO2(g) ![]() 2CO(g)��2H2(g)����H3����
2CO(g)��2H2(g)����H3����
��Ӧ���Է����е�������______________����H3��______________kJ��mol��1��
��.���Ĺ̶�һֱ�ǿ�ѧ���о�����Ҫ���⣬�ϳɰ������˹��̵��Ƚϳ���ļ�������ԭ��ΪN2 (g)��3H2 (g) ![]() 2NH3(g)��
2NH3(g)��
(2)�ڲ�ͬ�¶ȡ�ѹǿ����ͬ���������£���ʼN2��H2 �ֱ�Ϊ0.1 mol��0.3 molʱ��ƽ��������а����������(��)����ͼ��ʾ��

�����У�p1��p2 ��p3 �ɴ�С��˳����______________________________����ԭ����__________________________________________________________________��
�����ֱ���vA(N2)��vB(N2)��ʾ�ӷ�Ӧ��ʼ����ƽ��״̬A��Bʱ�Ļ�ѧ��Ӧ���ʣ���vA(N2)________vB(N2)(����>����<����������)��
������250 �桢p1 Ϊ105 Pa�����£���Ӧ�ﵽƽ��ʱ���������Ϊ1 L�����������B��N2 �ķ�ѹp(N2)Ϊ_____________________Pa (��ѹ����ѹ�����ʵ�������������һλС��)��
��.�����������(S2O![]() )Ϊý�飬ʹ�ü�ӵ绯ѧ��Ҳ�ɴ���ȼú�����е�NO��װ����ͼ��ʾ��
)Ϊý�飬ʹ�ü�ӵ绯ѧ��Ҳ�ɴ���ȼú�����е�NO��װ����ͼ��ʾ��

(3)���������ĵ缫��ӦʽΪ_________________________________��
��NO����ת�������Ҫ����ΪNH![]() ����ͨ��ʱ��·��ת����0.3 mol e�������ͨ����������������յ�NO�ڱ�״���µ����Ϊ________mL��
����ͨ��ʱ��·��ת����0.3 mol e�������ͨ����������������յ�NO�ڱ�״���µ����Ϊ________mL��
����������,��a mol��L-1�Ĵ�����b mol��L-1Ba(OH)2 ��Һ��������,��ַ�Ӧ��,��Һ�д���2c(Ba2+)=c(CH3COO-),��û����Һ�д���ĵ��볣��Ka=___________(�ú�a��b�Ĵ���ʽ��ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ҫ�Ļ�������ԭ��֮һ���ǻ�ѧ��ҵ������Ҫ�IJ�Ʒ���ųơ���ҵ֮ĸ��������ѧ��ѧ�̲����жദ�漰��Ӧ�á�
(1)����Ũ��������ϡ����
��֪ijŨ������ܶ�Ϊ1.84g/ml����������Ϊ98�������Ũ��������ʵ���Ũ��Ϊ_______��
���ø�Ũ��������480mlŨ��Ϊ1.84mol/L��ϡ���ᣬ�����ƹ����г���ȡŨ������������ձ�����ͷ�ι��⣬�����õ��IJ���������______________________��
(2)����������ķ�Ӧ
ʵ��������ϡ������п��Ӧ��ȡ����ʱ���������еμ���������ͭ��Һ�Լӿ췴Ӧ���ʣ���д�����������ӷ�Ӧ����ʽ______________________________�������ý���ͭ����Ũ���ᷴӦ�У�������Ũ�����___________________���ʣ��ǽ���̼�ڼ���������Ҳ����Ũ���ᷴӦ����Ҫ�����ʵ����鷴Ӧ���ɵ�����������������������ȷ˳��Ϊ______________________��
(3)�������л��е�Ӧ��
������������ʿ�����ȡ�����л����������ըҩTNT������������������ʡ����������ȡ���д����ȡTNT�Ļ�ѧ����ʽ________________________________________����д�����Ҵ���ȡ��ϩ�Ļ�ѧ����ʽ________________________________________��ϡ���ỹ����ʹ���ǡ����۵ȶ����л����ˮ�⣬��д������ˮ��IJ�������_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������һ����Ҫ�Ļ���ԭ�ϣ������Ʊ�һϵ������(����ͼ)������˵���������( )

A. ��ʽ������ˮ���ܲ���Fe(OH)3���壬��������ˮ��
B. Ϊ��ֹNH4HCO3�ֽ⣬����FeCO3���ڽϵ��¶��½��У��÷�Ӧ�����ӷ���ʽΪ��Fe2++2HCO3��= FeCO3+ CO2��+H2O
C. ����KSCN��Һ����(NH4)2Fe(SO4)2�Ƿ�����
D. ���¶��£�(NH4)2Fe(SO4)2��ˮ�е��ܽ�ȱ�FeSO4�Ĵ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£�![]()
![]() �ֱ�����Һ�дﵽ�����ܽ�ƽ��ı���Һ
�ֱ�����Һ�дﵽ�����ܽ�ƽ��ı���Һ![]() ������������Ũ�ȵı仯��ͼ��ʾ����ͼ�����������жϴ������
������������Ũ�ȵı仯��ͼ��ʾ����ͼ�����������жϴ������
A.![]()
B.������![]() �����ʹ��Һ��
�����ʹ��Һ��![]() ��䵽
��䵽![]() ��
��
C.![]()
![]() �����������Һ��
�����������Һ��![]() ��
��![]() �˻����
�˻����
D.![]() ��
��![]() �ֱ���
�ֱ���![]() ��
��![]() �����������Һ�дﵽ����
�����������Һ�дﵽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ�ֹ��ɽ����������(LiTaO3)�����������˲�����һ���Ʊ�����﮵��������£��ش��������⣺

��1��LiTaO3����Ļ��ϼ�Ϊ___��
��2��ͬ��A�ʺ�ɫ������Ҫ�ɷ���___��д��ѧʽ����������;��___����һ�ּ��ɣ���
��3������2��������___������������ҺB�������ӵij����Լ���___��
��4��HTaO3��___������ĸ����
a�����ܵ�ǿ�� b�����ܵ����� c�����ܵ�ǿ�� d�����ܵ�����
��5��������NaOH��Һת������ҺA�Ĺ����У�������Ӧ�����ӷ���ʽΪ___��
��6�����������к�Ta2O5����������Ϊ44.2%�����ʲ���TaԪ�ء�����100kg�÷��ϣ����������������Ʊ�___kgLiTaO3��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com