
【题目】人类最初使用的有机物大多源自于自然界,从樟科植物枝叶提取的精油中含有下列甲、乙、丙三种成分:

(1)甲中含氧官能团的名称为______,甲分子中处于同一平面的碳原子数量最多为___个。
(2)由甲转化为乙需经下列过程(己略去各步反应的无关产物,下同):

其中反应I的反应类型为______,反应Ⅱ的化学方程式为(注明反应条件)________。
(3)己知:RCHCHR![]() RCHO+RCHO;2HCHO
RCHO+RCHO;2HCHO![]() HCOOH+CH3OH
HCOOH+CH3OH
由乙制丙的一种合成路线图如下(A~F均为有机物,图中Mr表示相对分子质量):
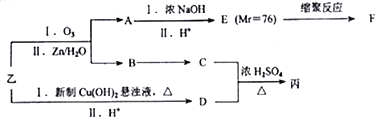
① 下列物质不能与C反应的是______(选填序号)
a.金属钠 b.HBr c.Na2CO3溶液 d.乙酸
②D有多种同分异构体,任写其中一种能同时满足下列条件的同分异构体结构简式_____。
a.苯环上连接着三种不同官能团 b.能发生银镜反应
c.能与Br2/CCl4发生加成反应 d.遇FeCl3溶液显示特征颜色
③ 写出乙与新制氢氧化铜悬浊液反应化学方程式________。
④ 写出F的结构简式_________。
⑥ 写出C和D反应生成丙的化学方程式__________。
【答案】 羟基 9 加成反应 ![]() c
c ![]()
![]()
![]()
![]()
【解析】(1)甲中含氧官能团是羟基,可以通过旋转连接苯环与C=C双键的C-C单键,使苯环与C=C双键构成的平面处于同一平面,分子中所以C原子都可能共面,故最多有9个C原子共面,故答案为:羟基;9;
(2)经过反应Ⅰ发现碳碳双键成为了单键,并且引入了Cl原子,所以反应为甲和氯化氢之间发生了加成反应,与氯原子相连的相邻碳原子含有氢原子,会发生消去反应生成乙,所以Ⅱ的方程式为:![]() +NaOH
+NaOH![]()
![]() +NaCl+H2O,故答案为:加成反应;
+NaCl+H2O,故答案为:加成反应;![]() +NaOH
+NaOH![]()
![]() +NaCl+H2O;
+NaCl+H2O;
(3)根据乙的结构简式和题干中所给信息,可知A是乙二醛,B是苯甲醛,乙在加热条件下与新制备氢氧化铜反应生成酸,D应为 ,则C应为醇,因B为苯甲醛,则C为苯甲醇,故丙为
,则C应为醇,因B为苯甲醛,则C为苯甲醇,故丙为![]() .E是相对分子质量为76,结合题给信息可知应为OH-CH2-COOH,本身能发生缩聚反应生成F为
.E是相对分子质量为76,结合题给信息可知应为OH-CH2-COOH,本身能发生缩聚反应生成F为![]() 。
。
①C为苯甲醇,含有羟基,可与钠反应生成氢气、与HBr发生取代反应、与乙酸发生酯化反应,不具有酸性,不能与碳酸钠反应,故答案为:c;
②该物质能发生银镜反应,一定含有醛基,可以和Br2/CCl4发生加成反应,含有碳碳碳双键,遇FeCl3溶液显示紫色,说明含有酚羟基,所以该物质的结构简式为![]() ,故答案为:
,故答案为:![]() ;
;
③乙为![]() ,含有醛基,可在加热条件下与新制备氢氧化铜浊液反应,方程式为C6H5CH=CHCHO+2Cu(OH)2+NaOH
,含有醛基,可在加热条件下与新制备氢氧化铜浊液反应,方程式为C6H5CH=CHCHO+2Cu(OH)2+NaOH![]() C6H5CH=CHCOONa+Cu2O↓+3H2O,故答案为:C6H5CH=CHCHO+2Cu(OH)2+NaOH
C6H5CH=CHCOONa+Cu2O↓+3H2O,故答案为:C6H5CH=CHCHO+2Cu(OH)2+NaOH![]() C6H5CH=CHCOONa+Cu2O↓+3H2O;
C6H5CH=CHCOONa+Cu2O↓+3H2O;
④由以上分析可知F为![]() ,故答案为:
,故答案为:![]() ;
;
⑤C和D反应生成丙的化学方程式为![]()
![]()
![]()
 ,故答案为:
,故答案为:![]() +
+![]()
![]()
 。
。


科目:高中化学 来源: 题型:
【题目】碳、氮、氧、铝都为重要的短周期元素,其单质及化合物在工农业生产生活中有重要作用。请回答下列问题:
(1)在密闭容器内(反应过程保持体积不变),使1molN2和3molH2混合发生下列反应:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4kJ/mol。当反应达到平衡时,N2和H2的浓度之比是_______;当升高平衡体系的温度,则混合气体的平均式量______(将“增大”“减小”或“不变”);当达到平衡时,再向容器内充入1mol N2,H2的转化率_______(填“提高”“降低”或“不变”);当达到平衡时,将c(N2)、c(H2)、c(NH3)同时增大1倍,平衡_______移动(填“正向”“逆向”或“不”)。
2NH3(g) △H=-92.4kJ/mol。当反应达到平衡时,N2和H2的浓度之比是_______;当升高平衡体系的温度,则混合气体的平均式量______(将“增大”“减小”或“不变”);当达到平衡时,再向容器内充入1mol N2,H2的转化率_______(填“提高”“降低”或“不变”);当达到平衡时,将c(N2)、c(H2)、c(NH3)同时增大1倍,平衡_______移动(填“正向”“逆向”或“不”)。
(2)由题干所述元素中的三种组成的某种强酸弱碱盐的化学式为________,其溶于水能_____水的电离(填“促进”或“抑制”),且使溶液的pH_______(填“升高”“降低”或“不变”),原因是_________(用离子方程式表示)。
(3)空气是硝酸工业生产的重要原料,氨催化氧化是硝酸工业的基础,氨气在铁触媒作用下只发生主反应①和副反应②:
4NH3(g)+5O2![]() 4NO+6H2O(g) △H=-905kJ/mol ①
4NO+6H2O(g) △H=-905kJ/mol ①
4NH3(g)+3O2![]() 2N2+6H2O(g) △H=-1268kJ/mol ②
2N2+6H2O(g) △H=-1268kJ/mol ②
①氮气与氧气反应生成NO的热化学方程式为______________________。
②在氧化炉中催化氧化时,有关物质的产率与温度的关系如图。下列说法中正确的是_____。

A.工业上氨催化氧化生成NO时,最佳温度应控制在780~840℃之间
B.工业上采用物料比![]() 在1.7~2.0,主要是为了提高反应速率
在1.7~2.0,主要是为了提高反应速率
C.加压可提高NH3生成NO的转化率
D.由图可知,温度高于900℃时,生成N2的副反应增多,故NO产率降低
(4)M是重要的有机化工原料,其分子与H2O2含有相同的电子数,将1molM在氧气中完全燃烧,只生成1molCO2和2molH2O,则M的化学式为_______。某种燃料电池采用铂作为电极催化剂,以KOH溶液为电解质,以M为燃料,以空气为氧化剂。若该电池工作时消耗1molM,则电路中通过_____mol电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列水溶液一定呈中性的是
A. c(NH4+)=c(C1-)的NH4Cl 溶液
B. c(H+)=1×10-7mol·L-1的溶液
C. pH=7的溶液
D. 室温下将pH=3的酸与pH= 11的碱等体积混合后的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是元素周期表的一部分。

I.用化学用语回答下列问题:
(1)②、⑥、⑧的离子半径由大到小的顺序为_________(用离子符号表示)。
(2)④、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是_______。(用化学式表示)
(3)As的原子结构示意图为_______;其氢化物的化学式为_______。
(4)Y由②⑥⑧三种元素组成,它的水溶液是生活中常见的消毒剂。As可与Y的水溶液反应,产物有As的最高价含氧酸,该反应的化学方程式为_________,当消耗1mol还原剂时,电子转移了______mol。
Ⅱ.A、B、C、D、E、X是上述周期表给出元素组成的常见单质或化合物。已知A、B、C、D、E、X存在如图所示转化关系(部分生成物和反应条件略去),若常温下A为红棕色气体,B为强酸,X为常见金属单质。

(5)A与水反应的化学方程式为_______________。
(6)工业上常用热还原法冶炼X,写出其化学方程式___________。
(7)某温度下(>100℃)若m克X与H2O反应放出QkJ(Q>0)的热量。写出该反应的热化学方程式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 从平衡常数的大小可以推断任意反应进行的程度
B. 对同一反应,K值越大,反应的转化率越大
C. K值越大,反应的转化率越小
D. 温度越高,K值越大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. H2SO4溶于水能电离出H+和SO42-,所以H2SO4是离子化合物
B. Ba(OH)2晶体中既存在共价键又存在离子键
C. 液态水汽化时,共价键断开,氢键无变化
D. 干冰升华时,共价键发生断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】体积相同、pH相同的HCl溶液和CH3COOH溶液,与NaOH溶液中和时两者消耗NaOH的物质的量( )。
A. 相同 B. 中和HCl的多 C. 中和CH3COOH的多 D. 无法比较
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)将钠、钾、镁、铝各1 mol分别投入到足量的0.1 mol·L-1的盐酸中,试预测实验结果:________________与盐酸反应最剧烈,
(2)将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,从而验证NaOH的碱性大于NH3·H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理______________?并说明理由:_____________________。
Ⅱ.利用下图装置可以验证非金属性的变化规律。

(3)仪器A的名称为____________,干燥管D的作用是______________。
(4)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性大于硫:装置B、C中所装药品分别为____________、________,装置C中的实验现象为有淡黄色沉淀生成,离子方程式为________________。
(5)若要证明非金属性:C>Si,则A中加________、B中加Na2CO3、C中加________,观察到C中溶液的现象为_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在工农业生产中有重要的作用。
(1)已知:C(s)+O2(g)=CO2(g) △H1=-393.5kJ/mol
②C(s)+CO2(g)=2CO(g) △H2=+172.5kJ/mol
③4Fe(s)+3O2(g)=2Fe2O3(g) △H3=-1651.0kJ/mol
CO还原氧化铁的热化学方程式为_______________________。
(2)高炉炼铁产生的高炉气中含有CO、H2、CO2等气体,利用CO和H2在催化剂作用下合成甲醇,是减少污染、节约能源的一种新举措,反应原理如下:CO(g)+2H2(g)=CH3OH(g) △H 。在体积不同的两个恒容密闭容器中分别充入1molCO和2moL H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如下图。

①在上图A、B、C三点中,选填下表物理且对应最大的点。
反应速率 | 平衡常数K | 平衡转化率a |
_________ | _________ | _________ |
②在300℃时,向C点平衡体系中再充入0.25molCO、0.5molH2和0.25mol的CH3OH,该反应向_________方向进行(城“正反应”、‘逆反应”或“不移动”)。
③一定温度下,CO的转化率与起始投料比[n(H2)/n(CO)]的变化关系如图所示,测得D点氢气的转化率为40%,则x=_____________。

(3)三氯化铁是一种重要的化合物,可以用来腐蚀电路板。某腐蚀废液中含有0.5mol·L-1Fe3+和0.26mol·L-1的Cu2+,欲使Fe3+完全沉淀[ c(Fe3+)≤4×l0-19]而Cu2+不沉淀,则需控制溶液pH的范围为_________。[KspCu(OH)2=2.6×l0-19;KspFe(OH)3=4×l0-38〕
(4)高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,工业上通过电解浓NaOH 溶液可制备Na2FeO4,然后转化为K2FeO4,电解原理如下图所示。

则A溶液中溶质的成分为___________________(填化学式);阳极的电极反应式为_____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com